由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| |
K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
| 溶解度/g |
111 |
33.7 |
11.1 |
6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。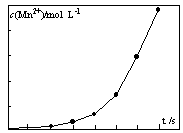
常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定不含有的阳离子是________;所含阴离子相同的两种盐的化学式是__________。
(2)M的化学式为_________________,M溶液显碱性的原因是_____________(用离子方程式表示)。
(3)X和Z的溶液反应的离子方程式是________________;
N和氨水反应的离子方程式是____________。
(4)若要检验Y中所含的阳离子,正确的实验方法是__________________。
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3、F2、NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有_______________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 |
Cl- Br- I- ClO- AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如下图所示。
则该溶液中确定含有的离子有 ;肯定不含有的离子有 ,滴加氢氧化钠过程中发生反应的先后顺序为(用离子方程式表示) 。
(2)若经检测,该溶液中含有大量的Cl—、Br—、I—,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl—、Br—、I—的物质的量与通入Cl2的体积(标准状况下)的关系如下图所示,回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
| n (Cl-) |
1.25mol |
1.5mol |
2mol |
| n (Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入的Cl2的体积为2.8L时,溶液中发生反应的离子方程式为: ,a= 。
②原溶液中Cl—、Br—、I—的物质的量浓度之比为 。
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O3、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)湿法制备高铁酸钠(Na 2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO—、OH-、FeO42—、Cl—、H2O。
①写出并配平湿法制备高铁酸钠的离子方程式: 。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是 。
(2)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na 2FeO4+2 Na 2O+2 Na 2SO4+O2↑
该反应中的还原剂是 ,氧化产物是 ,每生成l mol Na 2FeO4转移 mol电子。
(1)下列物质中能导电的有 属于电解质的有 属于非电解质的有 。(选填字母)
A.稀硫酸
B.纯醋酸
C.铜丝
D.氨水
E.乙醇
F.硫酸钡固体
G.熔融氯化钠
H.SO3
(2)下列配制一定物质的量浓度溶液的操作中使物质的量浓度偏大的是 ,偏小的是 ,无影响的是 。(选填字母)
A.配制硫酸铜溶液时,所用的胆矾部分风化。
B.配制氢氧化钠溶液时,称量固体时间过长。
C.配制稀硫酸时,用量筒量取浓硫酸时仰视读数。
D.配制稀硫酸时,在小烧杯中稀释浓硫酸后未冷却立即转移到容量瓶中并定容。
E.转移溶液前,容量瓶内有水珠。
F.定容时,加水超过刻度线,用胶头滴管吸取液体至刻度线。
(3)用洁净的烧杯取少量蒸馏水,加热至沸腾,向烧杯中逐滴加入氯化铁的饱和溶液,可制得红褐色的胶体。
①生成该胶体的离子方程式为 。
②向该胶体中逐滴加入HI稀溶液,会出现一系列变化:先出现红褐色沉淀,随后红褐色沉淀溶解,沉淀溶解的离子方程式为 。