高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O3、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)湿法制备高铁酸钠(Na 2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO—、OH-、FeO42—、Cl—、H2O。
①写出并配平湿法制备高铁酸钠的离子方程式: 。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是 。
(2)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na 2FeO4+2 Na 2O+2 Na 2SO4+O2↑
该反应中的还原剂是 ,氧化产物是 ,每生成l mol Na 2FeO4转移 mol电子。
80℃,101.3 kPa下,用图86装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH3、O2、N2、H2S、NO、CO2等气体,B筒内装有Na2O2固体,推动A的活塞使A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化(不考虑2NO2 N2O4)。
N2O4)。
图8-6
(1)C中发生的反应,其化学方程式是 。已知原C中的气体是单一气体,它是 ,理由是 。
(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前 C中的气体是。
(3)若实验开始前A、C中气体体积(换算成标准状况)分别为1.40 L和2.24 L,且A中的气体经过B管后,B管增重了1.40 g。经计算和推理可判定A中的气体是,其质量为g(不必写出计算和推理过程)。
在春夏之交的夜晚,墓地周围常出现“鬼火”,即磷火,这是尸骨中的Ca3P2与水反应生成PH3,PH3自燃的结果,写出Ca3P2与水反应的化学方程式:__________,再写出PH3发生自燃的化学方程式:_______________。
(1)舞台上的幕布与布景多是用浓NH4Cl溶液浸过制成的,可以防火,其原因是_____________________________。
(2)已知NH3结合H+的能力比结合Ag+的能力强。要使[Ag(NH3)2]+转化为自由的Ag+,应加入的试剂是_______,实现转化的离子方程式为______________________________________。
(3)氮的氧化物NOx与NH3反应生成N2和H2O,若在标准状况下1.5 L NOx和2 L NH3恰好完全作用,写出反应的化学方程式:____________________________,NOx中x值为___________。
根据下列变化进行推断:
已知强热A产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A____________、B____________、C____________、D____________。
(2)写出①②变化的离子方程式。
一种无色澄清溶液可能含有K+、SO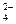 、NH
、NH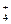 、Ba2+、H2PO
、Ba2+、H2PO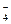 、NO
、NO 中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉淀产生,加热产生一种使湿润红色石蕊试纸变蓝的气体。②另取原溶液浓缩后加入浓硫酸、铜片并加热,产生红棕色气体。由此可知此溶液中一定含有_______离子,一定不含有_______离子。
中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉淀产生,加热产生一种使湿润红色石蕊试纸变蓝的气体。②另取原溶液浓缩后加入浓硫酸、铜片并加热,产生红棕色气体。由此可知此溶液中一定含有_______离子,一定不含有_______离子。