1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 |
Cl- Br- I- ClO- AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如下图所示。

则该溶液中确定含有的离子有 ;肯定不含有的离子有 ,滴加氢氧化钠过程中发生反应的先后顺序为(用离子方程式表示) 。
(2)若经检测,该溶液中含有大量的Cl—、Br—、I—,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl—、Br—、I—的物质的量与通入Cl2的体积(标准状况下)的关系如下图所示,回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
| n (Cl-) |
1.25mol |
1.5mol |
2mol |
| n (Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入的Cl2的体积为2.8L时,溶液中发生反应的离子方程式为: ,a= 。
②原溶液中Cl—、Br—、I—的物质的量浓度之比为 。
太阳能电池是利用光电效应实现能量变化的一种新型装置,目前多采用单晶硅和多晶硅作为基础材料。高纯度的晶体硅可通过以下反应获得:
反应①(合成炉):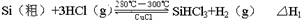
反应②(还原炉):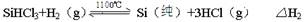
有关物质的沸点如下表所示:
| 物质 |
BCl3 |
PCl3 |
SiCl4 |
AsCl3 |
AlCl3 |
SiHCl3 |
| 沸点 |
12.1 |
73.5 |
57.0 |
129.4 |
180(升华) |
31.2 |
请回答以下问题:
(1)太阳能电池的能量转化方式为;由合成炉中得到的SiHCl3往往混有硼、磷、砷、铝等氯化物杂质,分离出SiHCl3的方法是。
(2)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应①的KP=;
(3)对于反应②,在0.1Mpa下,不同温度和氢气配比(H2/SiHCl3)对SiHCl3剩余量的影响如下表所示:
①该反应的△H20(填“>”、“<”、“=”)
②按氢气配比5:1投入还原炉中,反应至4min时测得HCl的浓度为0.12mol·L—1,则SiHCl3在这段时间内的反应速率为。
③对上表的数据进行分析,在温度、配比对剩余量的影响中,还原炉中的反应温度选择在1100℃,而不选择775℃,其中的一个原因是在相同配比下,温度对SiHCl3 剩余量的影响,请分析另一原因是。
(4)对于反应②,在1100℃下,不同压强和氢气配比(H2/SiHCl3)对SiHCl3剩余量的影响如图27—1所示: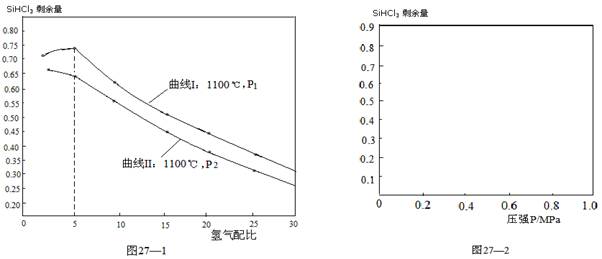
① 图中P1P2(填“>”、“<”、“=”)
②在图27—2中画出氢气配比相同情况下,1200℃和1100℃的温度下,系统中SiHCl3剩余量随压强变化的两条变化趋势示意图。
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。
其制备过程如下:
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na2SO3固体和某酸反应制备SO2气体;
③在一定温度下,将足量的SO2气体通入①的溶液中,即有保险粉生成,同时生成一种气体。
(1)写出NaOH的电子式
(2)制备SO2时所选用的酸,你认为下列最适宜选用的是
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
(3)制备保险粉的化学方程式可表示为
(4)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,则每消耗0.1mol保险粉,理论上可以除去Cr2O72-的物质的量为mol。
(5)保险粉不稳定,容易分解生成甲、 乙、 丙三种化合物。若将甲、乙两种物质分别配成溶液,在甲溶液中加入稀硫酸,则有淡黄色沉淀和气体丙产生;乙溶液中加入BaCl2溶液和稀盐酸,有气体丙产生,但无白色沉淀。在甲溶液中加入稀硫酸后所发生反应的离子方程式为保险粉分解的化学方程式为
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 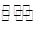 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 |
Cu2+ |
H+ |
Cl﹣ |
SO42﹣ |
| c/mol·L﹣1 |
0.5 |
2 |
2 |
0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
(15分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)单质铁属于______晶体,将FeCl3溶液加热蒸干,灼烧所得的物质是______ (填化学式):
(2)请写出铝与氢氧化钠溶液反应的化学方程式______________________________
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,在该深蓝色的浓溶液中加入乙醇所产生的现象是______,画出呈深蓝色的离子的结构式______.
写出Cu与氨水、双氧水反应的离子方程式:____________________________________.
(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,写出其化学方程式____________.
湿法炼锌的冶炼过程可用下图简略表示:
请回答下列问题:
(1)已知:N2(g)+2H2(g)===N2H4(l) ΔH=a kJ·mol-1,该反应不能自发进行,则a0(填“>”、“<”或“=”).
(2)ZnS焙烧的反应2ZnS+3O2 2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是,不含离子键的化合物是.
2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是,不含离子键的化合物是.
(3)电解过程中析出锌的电极反应式为___________________________.
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为.
(5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为。25℃时,以该电池为电源,用两个等质量的铜棒作电极电解500 mL 0.1mol/L CuSO4溶液,一段时间后切断电源,对电极干燥并称量,测得两电极的质量差为9.6 g,则至少需要________L空气(折算成标准状况)进入该电池。