NA为阿伏加德罗常数,下列物质所含分子数最多的是 ( )
| A.1 mol CO2 | B.标准状况下1.12L氨气 |
| C.2.2g二氧化碳(二氧化碳的摩尔质量为44g·mol-1) | D.含NA个氢原子的氢气分子 |
下列有关同系物的说法不正确的是
| A.分子组成相差一个或若干个CH2原子团的化合物必定互为同系物 |
| B.具有相同通式的有机物不一定互为同系物 |
| C.两个相邻同系物的相对分子质量数值一定相差14 |
| D.分子式为C3H8与C6H14的两种有机物一定互为同系物 |
为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是 ()
| 被提纯物质 |
除杂试剂 |
分离方法 |
|
| A |
乙酸乙酯(乙酸) |
NaOH溶液 |
蒸馏 |
| B |
CO2(SO2) |
饱和Na2CO3溶液 |
洗气 |
| C |
乙烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| D |
溴苯(溴) |
氢氧化钠溶液 |
分液 |
进行一氯取代反应后,只能生成三种沸点不同的有机产物的烷烃是()
| A.(CH3)2CHCH2CH3 | B.(CH3CH2)2CHCH3 |
| C.(CH3)2CHCH(CH3)2 | D.(CH3)3CCH2CH3 |
能够鉴别醋酸溶液、葡萄糖溶液、蔗糖溶液的试剂是()
| A.稀盐酸 | B.Cu(OH)2悬浊液 |
| C.NaOH溶液 | D.Na2CO3溶液 |
某有机物的结构简式为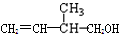 下列关于该有机物的叙述不正确的是( )
下列关于该有机物的叙述不正确的是( )
| A.能与金属钠发生反应并放出氢气 |
| B.能在催化剂作用下与H2发生加成反应 |
| C.在浓H2SO4催化下能与乙酸发生酯化反应 |
| D.能发生银境反应 |