下表是元素周期表的一部分,针对所给的11种元素,完成下列各小题。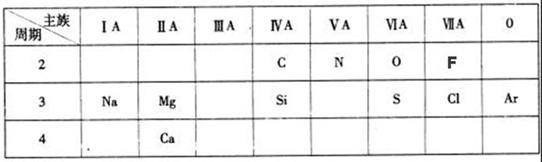
(1)化学性质最不活泼的元素是 (填元素名称);
(2)Cl原子结构示意图为 ;
(3)第三周期元素中,最高价氧化物对应水化物碱性最强的是 (填化学式);
(4)O和N中,原子半径较大的是 ;
(5)“高钙牛奶”中的钙是指 (填“元素”或“单质”);
(6)Cl的气态氢化物的稳定性比F的气态氢化物 (填强或弱);
(7)常温下为红棕色气体的氧化物的化学式是 。
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ;
(9)S元素形成的一种氢化物的化学式是 ,该物质中H元素与S元素的质量比
m(H):m(S)= 。(相对原子质量:H-1 S-32)
钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.
(1)钾和硝酸钾反应可制得氧化钾K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有___________g
(2)超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂.请尝试写出超氧化钾与二氧化碳反应的化学方程式____________,为了维持封闭环境气压稳定可以使用超氧化钾和过氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为______
(3)KO2加热至600℃部分分解得到固态混合物 A.6.30g A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),如果产物A只含有两种化合物,写出所有可能组成的化学式组合,并计算A中两种化合物的物质的量之比.________________________
工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g—0.5g.已知NaNO2能发生如下反应:aNO +xI—+yH+=bNO↑+cI2+zH2O,
+xI—+yH+=bNO↑+cI2+zH2O,
请回答下列问题:
(1)上述反应中,x、y、z的数值分别是(全对才给分),
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为.
(3)某工厂废切削液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是,
a.NaCl b.H2O2c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为:.
A~G各物质间的关系如下图,其中B、D为气态单质.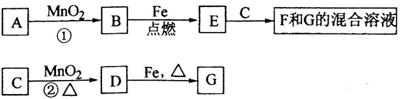
请回答下列问题:
(1)填写物质E的一个俗名_______________________;
(2)可选用不同的A进行反应①,若必须在加热下进行,其化学方程式为_____________;
(3)反应②的化学方程式为___________________________________________________;
(4)C、F、G的溶液通入B可转变成一种单一溶质水溶液,试写出该反应的离子方程式__________检验该溶液中阳离子的常用试剂是____________.

德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如右图)。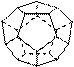
请回答: C20分子共有_______个正五边形,共有_______条棱边,C20晶体属于_______ (填晶体类型).