已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
| A.50 | B.0.02 | C.100 | D.无法确定 |
节能减排是指节约能源和减少环境有害物排放。国家“十二五规划”明确提出了节能减排的目标,即到2015年,单位GDP二氧化碳排放降低17%;单位GDP能耗下降16%。下列举措不符合“节能减排”这一要求的是
| A.倡导开私家车的人乘坐公交车上下班 |
| B.国家减免小排量轿车的购置税 |
| C.政府鼓励科研和生产部门开发、利用太阳能 |
| D.加快开发石油以缓解能源紧张问题 |
过氧化氢(H2O2)俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口及环境、食品消毒;实验室一般用过氧化钡(BaO2)与稀硫酸反应来制取。请问,过氧化钡(BaO2)中所含化学键为
| A.只有离子键 | B.离子键和共价键 |
| C.只有共价键 | D.离子键、共价键和氢键 |
2013年6月26日,中国第五艘载人飞船“神舟十号”在轨飞行15天之后返回地面,这标志着中国航天已进入空间站时代。据中国载人航天工程新闻发言人透露,此次飞行所使用的航天服每套总重量约120公斤,造价3000万元人民币左右。航天服最外面是聚四氟乙烯与玻璃纤维制成的保护层,以增大其强度。聚四氟乙烯的单体的结构简式为
| A.CF3—CF3 | B.CF2=CF2 |
| C.CF2—CF2 | D.CF3=CF3 |
价电子总数与原子总数都相同的分子、离子或原子团称为等电子体,等电子体具有相似的结构和性质。下列选项中互称为等电子体的是
A.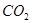 和 和 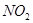 |
B.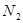 和 和 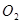 |
C.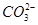 和 和 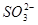 |
D.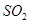 和 和 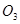 |
超铀元素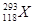 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子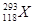 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |