(1)核素:人们把具有一定数目 和一定数目 的一种原子称为核素。
同位素: 相同而 不同的同一元素的不同原子互称为同位素。
(2)已知化学能与其他形式的能量能够相互转化:
二次电池充电是将 转化为 ;
植物光合作用是将 转化为 。
(6分)(3)写出下列物质的电子式:
N2 H2O CaCl2
在Pb(NO3)2溶液中加入NaI溶液,有现象产生,其离子反应式为;若在上层清夜中再加入KI溶液又有现象产生,其离子反应式是。说明
已知难溶于水的盐在水中存在溶解平衡,例如氯化银在水中的溶解平衡为:
AgCl(s)  Ag+(aq) + Cl-(aq)。在一定温度下,水溶液中银离子(Ag+)和氯离子(Cl-)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp = [Ag+]·[Cl-] = 1.8 × 10-10 mol2·L-2
Ag+(aq) + Cl-(aq)。在一定温度下,水溶液中银离子(Ag+)和氯离子(Cl-)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp = [Ag+]·[Cl-] = 1.8 × 10-10 mol2·L-2
现把氯化银(足量)分别放人:①100mL蒸馏水中;②100mL 0.1mol·L-1的盐酸溶液中;③1000mL 0.1 mol·L-l的氯化铝溶液中;④100mL0.1 mol·L-1的氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答)。在0.1mol·L-l氯化铝溶液中,银离子的物质的量浓度最大可达到mol·L-1。
浓度均为0.1mol/L的8种溶液:①HNO3②H2SO4③HCOOH④Ba(OH)2⑤NaOH⑥CH3COONa⑦KCl⑧NH4Cl,溶液pH值由小到大的顺序是:(填写编号)_ _。
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1mol/L的溶液100mL;
②用PH试纸测出该溶液的PH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制PH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_____________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的PH_________1(选填>、<、
=);
乙方案中,说明HA是弱电解质的现象是_____________(多选扣分)
(a)装HCl的试管中放出H2的速率快
(b)装HA溶液的试管的中放出H2的速率快
(c)两个试管中产生气体速率一样快
(3)请你评价:乙方案中难以实现之处和不妥之处________________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答: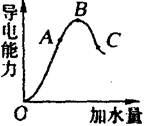
(1)“O”点导电能力为“0”的理由是
_______________________。
(2)A、B、C三点pH值由大到小的顺序是
_______________________。
(3)A、B、C三点电离程度最大的是____________________。