电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,电解开始后,在X极附近观察到溶液变红色,则X极与电源的____极连接,电解时X极上的电极反应为 ;检验Y电极上反应产物的方法是: ,电解过程中的总电解反应式为 。
(2)如果用该装置精炼铜,选用CuSO4作电解质溶液,则连接粗铜的是_______极(填写“X”或“Y”),析出Cu的一极的
电极反应式是 ,反应后,电解质溶液CuSO4的浓度___(填“变大”、“变小”或“不变”)。
一瓶无色气体,可能含有CH4和CH2=CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有无色油状小液滴。
①由上述实验现象推断出该混合气体中一定含有CH4,你认为是否正确,说明理由。
②上述实验过程中涉及的反应类型有。
乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃
后充分反应,乙烯和乙烷全部消耗完,得到CO到CO2的混合气体和45g水。试求:
⑴ 当a =1时,乙烯和乙烷的物质的量之比n (C2H4)∶n (C2H6)=。
⑵ 当a =1,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则
b=,得到的CO和CO2的物质的量之比n (CO)∶n (CO2)=。
⑶ a的取值范围是。
⑷ b的取值范围是。
2005年诺贝尔化学奖授予法国和美国的伊夫•肖万、罗伯特•格拉布和理查德•施罗克,以表彰他们在烯烃复分解反应研究领域作出的卓越贡献。烯烃复分解反应如下所示(炔烃也能发生此类反应):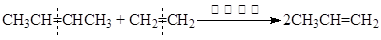 即从总效果看,是双键断裂后部分重新组合。
即从总效果看,是双键断裂后部分重新组合。
(1)以下反应不属于烯烃复分解反应的是______________(填序号)。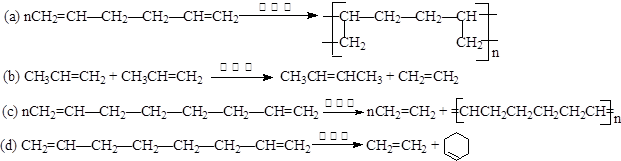 (2)写出丙炔与丙炔发生复分解反应的化学方程式:
(2)写出丙炔与丙炔发生复分解反应的化学方程式:
________________________________。
(3)烯烃复分解反应可以合成其他反应难以合成的物质,写出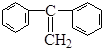 制取
制取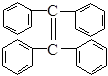 的化学方程式:________________________________________。
的化学方程式:________________________________________。
(4)人们在上世纪50年代已发现了烯烃复分解反应,到了70年代由伊夫•肖万揭示了反应机理,并制得了钛、钨、钼等金属卡宾。烯烃复分解反应有着广阔的应用前景。则后两位化学家所作的贡献应是___________(填序号,多项选择)。
(a)找到了更价廉的金属卡宾
(b)找到了在更多化学环境都有催化活性的金属卡宾
(c)使反应原理转化为实际应用
已知碳原子数小于或等于8的单烯烃与HBr反应,其加成产物只有一种结构。
(1)符合此条件的单烯烃有种,判断的依据是
;
(2)在这些单烯烃中,若与氢气加成后,所得烷烃的一氯代物的同分异构体有三种。这样的单烯烃的结构简式为。
某学生有0.1000mol/L KOH溶液滴定未知尝试的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制____________(填仪器及部位),眼睛注视____________________,直至滴定终点。判断到达终点的现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并有来滴定上述盐酸,则对测定结果的影响是___________________________________________________-。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______________。