已知:2H2(g)+O2(g)=2H2O(g);ΔH=-270kJ·mol-1,下列说法错误的是( )
| A.2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量 |
| B.2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ |
| C.在相同条件下,2mol氢气与1mol氧气的能量总和大于2mol水蒸汽的能量 |
| D.2个氢气分子与1个氧气分子反应生成2个水蒸汽分子放出270kJ热量 |
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有
| A.①③④⑤ | B.全部 | C.①②⑥ | D.②③⑥ |
下列气体中,直接排放到大气而不会产生污染的是
| A.NO | B.O3 | C.CH4 | D.CO2 |
亚碘酸钠的化学式为
| A.NaI | B.NaIO | C.NaIO2 | D.NaIO3 |
在酸性条件下H2C2O4可以被KMnO4溶液氧化,使KMnO4溶液褪色,依据KMnO4溶液褪色时间的长短可以比较反应进行的快慢。下列各组实验中溶液褪色最快的是
| 组号 |
反应温度 /℃ |
参加反应物质 |
||||
| KMnO4 |
H2C2O4 |
MnSO4 |
||||
| V/mL |
c/mol·L-1 |
V/mL |
c/mol·L-1 |
m/g |
||
| A |
20 |
4 |
0.1 |
2 |
0.1 |
0 |
| B |
20 |
4 |
0.1 |
2 |
0.1 |
0.1 |
| C |
40 |
4 |
0.1 |
2 |
0.1 |
0 |
| D |
40 |
4 |
0.1 |
2 |
0.2 |
0.1 |
烯烃存在顺反异构现象,已知:
①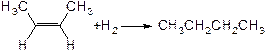 △H=-119.6kJ/mol
△H=-119.6kJ/mol
②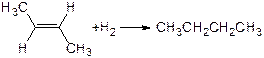 △H=-115.6kJ/mol
△H=-115.6kJ/mol
下列说法中正确的是
| A.上述两个反应中,反应物的总能量均低于生成物的总能量 |
| B.上述两个反应中,破坏旧键需要的能量均大于形成新键所释放的能量 |
| C.从上述反应热数据可知顺-2-丁烯比反-2-丁烯稳定 |
| D.顺-2-丁烯转化为反-2-丁烯的反应热可表示为 |
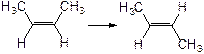 △H=-4.0kJ/mol
△H=-4.0kJ/mol