食盐中含有一定量的镁、铁等杂质元素,某学习小组对加碘盐进行如下实验(已知:氧化性:IO-3>Fe3+>I2);取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶液解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变化。
(1)由此可知,该加碘盐中的含碘物质是 (填化学式);
(2)第一份试液加KSCN溶液显红色,写出该反应的离子方程式 ;
(3)第二份试液加CCl4萃取后下层溶液中显紫红色的物质是 (填化学式):
(4)第二份试液中加入足量KI固体,先后发生反应的离子方程式为 。
质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。又如CH3-CHBr=CHX存在着如下的两种不同空间结构:
因此CH3-CHBr=CHX的PMR谱上会出现氢原子的四种不同信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物质结构简式可能为:;
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物结构式为:_____________________。
某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简简式__________________________________________。
下列实验操作或叙述正确的是(填序号,多选倒扣分,扣完为止。)
| A.乙醇中含有少量水可加入金属钠再蒸馏制得无水乙醇 |
| B.将无水乙醇和浓硫酸按体积比3:1混合,加热至140°C制取乙烯 |
| C.蔗糖水解用稀硫酸作催化剂,加热一段时间,然后加入银氨溶液检验是否发生了水解 |
| D.在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质 |
E.油脂在皂化反应后,反应混合物中加入食盐可将肥皂分离出来
F.植物油和裂化汽油可用溴水鉴别
海水的综合利用可以制备金属钠和镁,其流程如下图所示: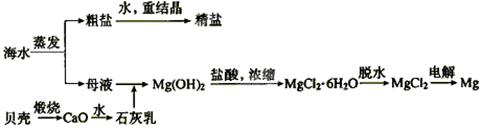
(1)上述流程中生成氢氧化镁沉淀的离子方程式为。氢氧化镁沉淀和盐酸反应的离子方程式为。
(2)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用:
溶解时:____________;过滤时:____________;蒸发时:______________。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅧA |
0 |
|
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,最易失电子的元素是,非金属性最强的元素是 ;
(2)化学性质最不活泼的元素是 ,其原子的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的是,呈两性的氢氧化物是。