下列各组热化学方程式中,化学反应的△H1大于△H2的是( )
①C(s)+O2(g)===CO2(g);△H1; C(s)+1/2O2(g)===CO(g);△H2
②2H2(g)+O2(g)==2H2O(g)△H1 ; 2H2(g)+O2(g)==2H2O(l)△H2
③H2(g)+Cl2(g)==2HCl(g)△H1 ; 1/2H2(g)+1/2Cl2(g)==HCl(g)△H2
④CaCO3(s)===CaO(s)+CO2(g);△H1 ; CaO(s)+H2O(l)===Ca(OH)2(s);△H2
| A.①③ | B.①④ | C.②④ | D.②③ |
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
()
①加盐酸溶解
②加烧碱溶液溶解
③过滤
④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3沉淀
⑥加入过量烧碱溶液
| A.①⑥⑤③ | B.②③④③ | C.②③⑤③ | D.①③⑤③ |
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是()
①向饱和碳酸钠溶液中通入过量的CO2;
②向NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸
| A.①② | B.①③ | C.①④ | D.②③ |
将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是()
| A.3 mol·L-1盐酸 |
| B.4 mol·L-1 HNO3溶液 |
| C.5 mol·L-1 NaOH溶液 |
| D.18.4 mol·L-1 H2SO4溶液 |
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图所示),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是()
| A.实验中发生的反应都是氧化还原反应 |
| B.铝是一种较活泼的金属 |
| C.铝与氧气反应放出大量的热量 |
| D.铝片上生成的白毛是氧化铝和氧化汞的混合物 |
下列类比关系正确的是()
A.AlCl3与过量NaOH溶液反应生成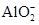 ,则与过量NH3·H2O反应也生成 ,则与过量NH3·H2O反应也生成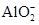 |
| B.Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 |
| C.Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 |
| D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 |