已知碱存在下,卤代烃与醇反应生成醚(R1—O--R2):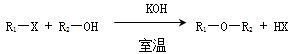
化合物A经下列四步反应可得到常见溶剂四氢呋喃,反应框图如下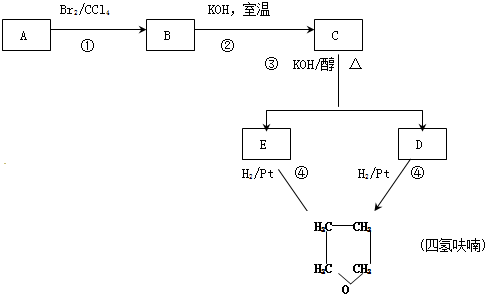
请回答下列问题:
(1)1molA和1molH2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为 ,A中所含官能团的名称是 A的结构简式
(2)第①③步反应类型是① ③
(3)已知E的核磁共振氢谱中出现两组峰,写出C生成E的化学方程式
(4)A有很多异构体,其中能和氢氧化铜反应生成红色沉淀的有 种
某元素R的二价阴离子核外共有a个电子,核内有b个中子,则R原子的符号应表示为:。
金属钠在700℃ ~800℃时与四氯化钛(TiCl4)反应制取金属钛,该反应的化学方程式为。若过量的相同质量的钠、镁、铝与相同质量分数,相同质量的硫酸溶液反应,产生氢气最多的是。
用11.5g金属钠放入水中,要使100个水分子溶有1个钠离子,则需加水g。
现有X、Y、Z三种非金属元素,A、B、C三种金属元素,已知有如下情况:
(1)X、Y、Z的单质在常温下均为气体
(2)X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
(3)XZ易溶于水,XZ的水溶液可使石蕊试液变红。
(4)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体。
(5)Z的单质溶于X2Y中所得溶液具有漂白性。
(6)A的单质可以在Z的单质中燃烧,生成棕褐色固体,该固体溶于水呈棕黄色。
(7)B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成。
(8)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色。
请完成下列问题:
①写出XZ、X2Y和BZ2的化学式:XZ,X2Y,BZ2。
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是(填化学式)
③A的单质与Z的单质反应的化学方程式:。
④C的单质与Y单质反应生成淡黄色物质的化学方程式:。
⑤Z单质能否与NaOH溶液反应?(填“能”或“不能”)。若能,请写出反应的化学方程式:。(若不能反应,则此空不必填写)。
把少量金属钠投入下列溶液中,写出有关反应的化学方程式:
(1)钠投入稀盐酸中。
(2)钠投入硫酸铜溶液中。