将少量SO2通入Fe2(SO4)3溶液中发生反应:SO2+2Fe3++2H2O = SO42-+2Fe2++4H+;然后再加入K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O。下列判断正确的是
| A.还原性Cr3+> Fe2+> SO2 | B.氧化性Cr2O72-> SO2> Fe3+ |
| C.两个反应中Fe2(SO4)3均作还原剂 | D.Cr2O72-能将SO2氧化成SO42- |
CaCO3溶于盐酸生成CO2,则下列说法中正确的是()
A.该反应的离子方程式为CO +2H+====CO2↑+H2O +2H+====CO2↑+H2O |
| B.与同浓度盐酸反应,块状大理石的反应速率比粉末状的快 |
| C.CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使CaCO3的Ksp增大 |
D.CaCO3与适量的盐酸恰好完全反应所得溶液中c(H+)=c(OH)+2c(CO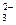 )+c(HCO )+c(HCO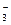 ) ) |
右图为室温下20 mL一定物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的图示,据图推出盐酸和NaOH溶液的物质的量浓度(mol·L-1)分别是()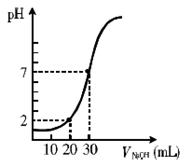
| A |
B |
C |
D |
|
| c(HCl)(mol·L-1) |
0.06 |
0.04 |
0.03 |
0.09 |
| c(NaOH)(mol·L-1) |
0.04 |
0.06 |
0.09 |
0.03 |
电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质常用于制造太阳能电池,w的原子半径是同周期中最小的。下列推断中正确的是()
| A.Z的氢化物的热稳定性强于w的氢化物 |
| B.z的氧化物与水反应可制得相应的含氧酸 |
| C.X、Y、W的原子半径依次减小,对应的离子半径依次增大 |
| D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 |
Li—SO2电池具有输出功率高和低温性能好等特点,其电解质是LiBr,溶剂是碳酸丙烯酯和乙睛,电池反应为2Li+2SO2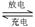 Li2S2O4。下列说法正确的是()
Li2S2O4。下列说法正确的是()
| A.该电池反应为可逆反应 |
| B.放电时,Li+向负极移动 |
| C.充电时,阴极反应式为Li++e-===Li |
| D.该电池的电解质溶液可以换成LiBr的水溶液 |
盖斯定律认为能量总是守恒的,化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
己知:①H2O(g)=====H2O(l)△H1===Q1kJ·mol-1
②C 2H 5OH(g)====C2H 5OH(l)△H2="===Q" 2 kJ·mol-1
③C 2 H 5 OH(g)+3O2(g)——2CO2(g)+3 H 2 O(g)△H3====Q 3 kJ·mol-1
若使23g液态酒精完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+Q2+Q3 | B.1.5Q1-0.5Q2+0.5Q3 |
| C.0.5Q1-1.5Q2+0.5Q3 | D.0.5(Q1+Q2+Q3) |