某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
| A.该装置为原电池,通入O2的电极是负极 |
| B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e- =2H++SO42- |
| C.该装置中,H+通过质子膜向左侧移动 |
| D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4 |
有关实验操作正确的是
| A.溴苯中混有溴:加入碘化钾溶液后分液 |
| B.除去SO2中的少量CO2:通过盛有饱和Na2CO3溶液的洗气瓶 |
| C.用玻璃棒在过滤器上搅拌以加速AgCl沉淀的洗涤 |
| D.中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,不影响测定结果 |
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: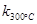 >
> ,且体系中
,且体系中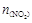 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
| 时间(s) |
0 |
500 |
1000 |
1500 |
| t1℃ |
20 |
13.96 |
10.08 |
10.08 |
| t2℃ |
20 |
a |
b |
c |
下列说法一定正确的是
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D.如果t2℃>t1℃,那么b>10.08
下列叙述正确的是
①离子化合物中不一定含有金属阳离子②分子晶体中不一定含有共价键
③有机物中不一定都含有氢元素④酸酐都能直接与水反应生成相应的酸
⑤酸与碱混合都只发生中和反应⑥酸式盐溶于水得到的溶液都显酸性
| A.只有①② | B.只有①②③ |
| C.只有③⑤⑥ | D.只有①②④⑥ |
将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气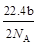 L L |
B.反应后溶液中的Cl―数目为: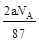 |
C.NA可表示为: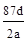 |
D.反应后溶液中的H+数目为: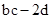 |
在中学化学实验室经常用到下列实验装置,其中不可用于物质分离的装置是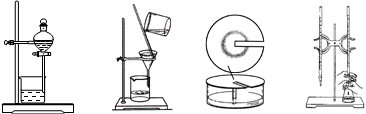
A. B. C. D.