化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198kJ·mol—1、P-O 360kJ·mol—1、氧气分子内氧原子间的键能为498kJ·mol—1。则P4(s)+ 3O2(g) ="=" P4O6(s)的反应热∆H为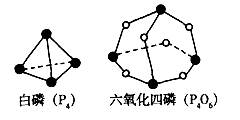
| A.+1638 kJ·mol-1 | B.-1638 kJ·mol-1 |
| C.-126 kJ·mol-1 | D.+126 kJ·mol-1 |
2006年9月份,“SK—Ⅱ”化妆品事件一时闹得沸沸扬扬。其实,从毒韭菜到炸鸡翅、从儿童奶粉到“瘦肉精”事件,化学性污染事件报道层出不穷,其中尤以食品安全最为引人恐慌。如食品报道中不断有①“致癌农药”、②“苏丹红”、③“碘元素”、④“亚硝酸盐”等化学名词出现。上述化学名词所提到的物质中,在某食品添加剂中允许含有但符合限量时不会引起中毒的是
| A.②③④ | B.②③ | C.③④ | D.只有③ |
实验室可以使用如右图所示装置制取的气体,且药品选用也正确的是k*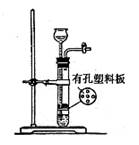
| A.O2:二氧化锰和双氧水 | B.SO2:亚硫酸钠和稀硫酸 |
| C.CO2:大理石和稀硫酸 | D.H2S:硫化亚铁和稀硫酸 |
设NA为阿伏加德罗常数,下列说法一定正确的是
| A.在1mol/L的FeCl3溶液中,Fe3+的个数小于NA |
| B.1 mol单质铜与足量硫或氯气反应失去电子数均为2NA |
| C.1mol碳烯(:CH2)中含有电子数为8NA |
| D.在标准状况下,22.4 L NO与11.2 L O2充分反应后,所得气体的分子数为NA |
四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种流体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是


A B C D