下列热化学方程式或离子方程式中,正确的是:
| A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓ |
| D.氧化铝溶于NaOH溶液:Al2O3+2OH-=2AlO2-+H2O |
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图。下列说法正确的是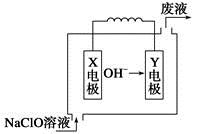
| A.镁作Y电极 |
| B.电池工作时,Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
D.X电极上发生的反应为ClO-+2H2O-4e-=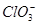 +4H+ +4H+ |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC的工作原理如图如示。下列有关说法正确的是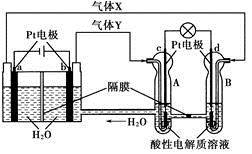
A.当有0.1 mol电子转移时,a电极产生2.24 L H2(标况)
B.b电极上发生的电极反应式为4H2O+4e-=2H2↑+4OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应式为O2+4H++4e-=2H2O
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是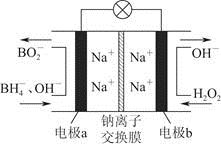
| A.电池放电时,Na+从b极区移向a极区 |
| B.电极a采用MnO2,放电时它被还原 |
| C.该电池负极的电极反应式为BH+8OH--8e-=BO+6H2O |
| D.放电时,a极区溶液的pH升高,b极区溶液pH降低 |
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是

A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0 2Z(g) ΔH>0 |
| B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件一定是增大了反应物的浓度 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |