下列晶体或分子中,含有化学键类型有差异的一组是 ( )
| A.H2O、CO2 | B.MgF2、H2O2 | C.NaOH、Ba(OH)2 | D.NaCl、KCl |
已知四种盐的溶解度(S)曲线如下图所示,下列说法不正确的是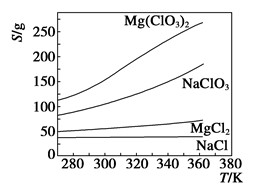
| A.将NaCl溶液蒸干可得NaCl固体 |
| B.将MgCl2溶液蒸干可得MgCl2固体 |
| C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 |
| D.可用MgCl2和NaClO3制备Mg(ClO3)2 |
甲、乙两物质的溶解度曲线如图所示。下列叙述中正确的是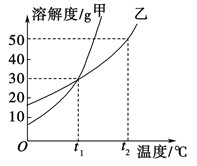
| A.t1℃时,在100 g水中放入60 g甲,其溶质的质量分数为37.5% |
| B.t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等 |
| C.t2℃时,甲和乙的饱和溶液中溶质的质量分数一定相等 |
| D.t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和 |
下列有关分散系的说法正确的是
| A.一种分散系中可以有一种分散质,也可以有多种分散质 |
| B.浊液的分散质都能通过过滤从分散剂中分离出来 |
| C.分散剂一定是液体 |
| D.同一种溶质的饱和溶液要比不饱和溶液的浓度大 |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
已知:
2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.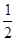 H2SO4(aq)+ H2SO4(aq)+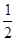 Ba(OH)2(aq)=== Ba(OH)2(aq)===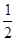 BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1 |