下列顺序不正确的是( )
| A.微粒半径Na+<K+<Cl-<S2- | B.稳定性HI>HBr>HCl>HF |
| C.酸性H4SiO4<H3PO4<H2SO4<HClO4 | D.碱KOH>Ca(OH)2>Mg(OH)2>Al(OH)3 |
下列说法正确的是()
| A.二氧化硫、三氧化硫互为同分异构体 |
| B.碘晶体、碘蒸气是同素异形体 |
| C.氕、氘、氚互为氢元素的同位素 |
| D.乙炔、苯的最简式同为(CH)n,两者互为同系物 |
下列电解质在水溶液中和熔化状态下均能导电的是()
| A.硫酸 | B.碳酸钙 | C.氢氧化钠 | D.氧化镁 |
下列有关除杂的实验操作合理的是()
| A.除去石英(主要成分为SiO2)中少量碳酸钙:用稀盐酸溶解后过滤 |
| B.除去甲苯中混有的少量苯酚:加入浓溴水后过滤 |
| C.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 |
| D.除去乙酸乙酯中混有的少量乙酸、乙醇:加入饱和氢氧化钠溶液振荡、静置后分液 |
下列化学用语错误的是()
A.氨分子的结构式: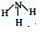 |
B.二氧化碳的电子式: |
C.Mg2+的结构示意图: |
D.乙烯的最简式:CH2 |
联合国气候变化大会于2010年11月在墨西哥召开。“减碳”措施之一是节能。下列制氢方法最节能的是()
| A.金属钠与水反应:2Na+2H2O→2NaOH+H2 |
| B.焦炭与水反应:C+H2O→CO+H2 |
| C.太阳能光催化分解水:2H2O→2H2+O2 |
| D.天然气与水反应:CH4+H2O→CO+3H2 |