理论上讲,任何自发的氧化还原反应都可以设计成原电池。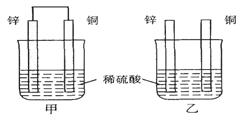
(1)将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,则甲、乙两种装置中属于原电池的是 ,甲装置中铜片上的现象是 。
(2)利用反应“ Fe + 2 Fe3+ =3 Fe2+ ”可以设计一个化学电池,若正极材料用石墨碳棒,则该电池的负极材料是 ,电解质溶液是 。
(3)据报道,最近摩托罗拉公司研制了一种由CH3OH和O2以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。已知该电池的总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则该燃料电池的正极上的电极反应式为 ,当外电路通过1.2mole-时,理论上消耗CH3OH g。
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨的原理是: △H <0,生产流程如右图所示。
△H <0,生产流程如右图所示。
①X的化学式为;
②右图中条件选定的主要原因是(选填字母序号) ;
A.升高温度、增大压强均有利于提高氨的转化率
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③若升高温度,达新平衡时,平衡常数将__________(填增大或减小或不变)。
④改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号);
(2)常温下氨气极易溶于水,其水溶液可以导电。
⑤用方程式表示氨气溶于水且显弱碱性的过程:
;
⑥氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
⑦将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为。
芬必得是一种解热、镇痛及抗生素类药物的商品名,其主要成分是化合物对异丁基-α-甲基苯乙酸,药名为布洛芬,它有多种合成路线,下面是一种合成方法: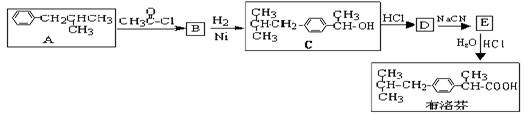
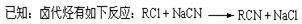 ,
,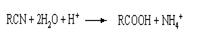
回答下列问题:
(1)写出有机物B、D的结构简式:BD
(2)写出反应类型:A→BB→C
(3)有机物C和苯酚的关系是(填选项字母)
A 、互为同分异构体 B、互为同系物
C、均属于芳香族化合物D、均属于芳香醇类
(4)根据布洛芬结构,下列判断不正确的是(填选项字母)
A、芳香族化合物 B、苯甲酸的同系物
C、能与溴水发生加成反应而使溴水褪色 D、能使酸性高锰酸钾溶液褪色
(5)与A具有相同分子式,且苯环上只有一个取代基的有机物共有四种,写出除A外的其余三种的结构简式:,,
(6)写出由E生成布洛芬的化学方程式:
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子且互不重复)
| 阳离子 |
K+、Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO—、Cl—、OH—、SO42— |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B的溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是
(2)写出C溶液和D溶液反应的化学方程式
(3)25℃时pH=9的A 溶液和pH=9的C溶液中水的电离程度小的是 (填写A或C的化学式)
(4)25℃时用惰性电极电解D的水溶液,一段时间后溶液的pH 7;(填>、< 或=)
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为
(6)室温时在一定体积0.2mol·L—1的C溶液中,加入一定体积的0.1mol·L—1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是
某学生利用物质间的互变,设计成一个平面魔方,如下图所示:
已知①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。B具有氧化性,能将SO2氧化为F(H2SO4),F与A反应生成E、G。
| 纯A(单质) |
B溶液 |
C固体 |
D固体 |
G溶液 |
|
| 颜色 |
银白色 |
黄色 |
红褐色 |
红棕色 |
浅绿色 |
③
依据以上信息填空:
(1)请写出E的电子式 、D的化学式。
(2) 请指出A、B、C、D、G所含的同种元素在周期表中的位置第周期第族,
(3)G生成C的过程中所出现的现象为
(4)写出下列反应的化学方程式:
E→A A→B
(5)B→F的离子方程式为
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测
NCl3水解的主要产物是 (填化学式)。