下列化学性质中,烷烃具有的是 ( )
| A.可发生加成反应 | B.能使溴水褪色 |
| C.与氯气发生取代反应 | D.能使高锰酸钾溶液褪色 |
已知反应: ①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
| A.碳的燃烧热110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀醋酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
| D.稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(1),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(1),热效应为ΔH3。则下列判断正确的是
| A.ΔH2>ΔH3 | B.ΔH1+ΔH3=ΔH2 | C.ΔH1<ΔH3 | D.ΔH1+ΔH2=ΔH3 |
下列说法正确的是
| A.电池充电时其正极应与外电源的负极相连而成为阴极 |
| B.氢氧燃料电池(碱性介质)的正极反应式:O2 +4e- →2O2- |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.铁件上镀铜时,将铁件与电源的负极相连 |
下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g)△H1 C(s)+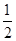 O2(g)===CO(g)△H2
O2(g)===CO(g)△H2
②S(s)+O2(g)===SO2(g)△H1 S(g)+O2(g)===SO2(g)△H2
③H2(g)+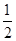 O2(g)===H2O(l)△H1 2H2(g)+O2(g)===2H2O(l)△H2
O2(g)===H2O(l)△H1 2H2(g)+O2(g)===2H2O(l)△H2
④CaCO3(s)===CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)===Ca(OH)2(s)△H2
| A.① | B.②③④ | C.④ | D.①②③ |
指常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是
| 共价键 |
H-H |
F-F |
H-F |
H-Cl |
H-I |
| E(kJ·mol-1 ) |
436 |
157 |
568 |
432 |
298 |
A.432 kJ·mol -1>E(H-Br)>298 kJ·mol -1
B.表中最稳定的共价键是H—F键
C.H2(g)+F2(g)=2HF(g) △H=—25 kJ·mol -1
D.H 2(g)→2H(g) △H=+436 kJ·mol -1