原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,盛 的试管中气体产生较快,盛 的试管中气球变得更大;
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3—(aq)+ H+(aq) ="===" H2O(l)+ CO2(g) △H>0
CO32—(aq)+ 2H+(aq) ="===" H2O(l)+ CO2(g) △H<0
甲下结论的方法是否正确 (填“正确”或“不正确”)
(3)为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 |
试剂1 |
试剂2 |
混合 前温度 |
混合后最高 或最低温度 |
| ① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
| ② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
| ③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
| ④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
| ⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
| ⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
通过上述实验可得出五条结论
a:NaHCO3的溶解是 (吸热或放热)过程;
b:Na2CO3的溶解是 (吸热或放热)过程;
c:NaHCO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
e:NaHCO3固体与稀盐酸反应的反应热是由 (填a→d的字母)的热效应之和。
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
| A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红 |
| B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红 |
| C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成 |
| D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 |
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
| 实验 |
酸或碱 |
现象 |
| A |
1滴0.2mol/LNaOH溶液 |
不变色 |
| B |
1滴水 |
缓慢变浅棕褐色 |
| C |
1滴0.1mol/L硫酸溶液 |
迅速变棕褐色 |
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5mL3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2=KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。
。
(5)实验室用二氧化锰和浓盐酸制取氯气,下列仪器可作为该反应的反应容器的是(填序号)。




A B C D
(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为 。
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
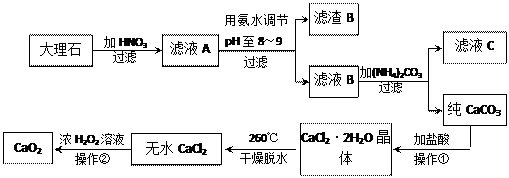 |
请回答下列问题:
(1)操作①应包括下列操作中的 (填序号)。
| A.溶解 | B.过滤 | C.蒸馏 | D.分液 E.蒸发结晶 |
(2)用氨水调节pH至8~9的目的是 。
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。;用简要的文字解释需用氢氧化钠调节pH至9~11的原因 。
(6)已知大理石含CaCO3的质量分数为a,mg大理石可以制得ngCaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率为
物质A、B、C有如下转化关系:
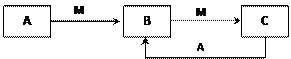 |
请回答下列问题:
(1)若A、B、C均为含铝元素的化合物,M的化学式可以是 。
(2)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子,C的化学式是 ,请写出C的一种用途 。
(3)若A是一种黄绿色气体,M是一种常见金属。写出C→B的离子方程式
。
(4)若A、B、C都是含硫化合物,已知:
A转化为B的热化学方程式为:2H2S(g)+ O2(g) =2S (s)+2H2O(l) △H=" -a" kJmol-1;
A转化为C的热化学方程式为:2H2S(g)+ 3O2(g) =2SO2(g)+2H2O(l) △H="-b" kJmol-1;
请写出A与C反应转化为B的热化学方程式。
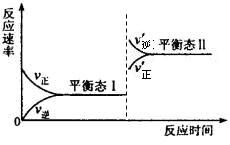
(5)若C+A→B的转化关系为4NH3+6NO 6H2O+5N2。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
6H2O+5N2。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系图如右。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
(14分)实验题:某班级的探究小组研究氧化铜能否在氯酸钾的受热分解中起到催化剂的作用,设计了如下实验:
(一)制备氧化铜
(1)称取5.0g CuSO4·5H2O晶体,研细后溶解:此步骤需要的仪器有________________________。
(2)向盛有硫酸铜溶液的烧杯中滴加NaOH溶液,直到不再产生沉淀为止。此步实验现象:____________;离子方程式为:_________________。
(3)A.把步骤(2)中的溶液和沉淀转移到蒸发皿内,稍微加热至沸腾,搅拌,直到沉淀全部变为黑色固体,停止加热,再过滤、洗涤、干燥、再转移到研钵中研细备用。
B.把步骤(2)中的溶液和沉淀转移到过滤器中过滤,洗涤,将上述沉淀在蒸发皿中进行蒸发,至全部变为黑色固体为止。再转移到研钵中研细备用。
你认为那一个步骤更好,说明理由:______________________。
(二)证明氧化铜起催化剂作用
设计对比实验①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的ng氧化铜粉末;②将两份氯酸钾同时在相同条件下正确加热,将放出的气体通入水中;③停止加热,冷却,将原先混有氧化铜的反应后混合物加水溶解,小心过滤,得到滤出物,洗涤并干燥;④观察滤出物的颜色和状态;⑤将滤出物和炭粉混和,在密闭容器中高温加热,将反应产生的气体通入澄清的石灰水中,并观察试验现象。
请回答下列问题:
(1)氧化铜作催化剂的理论依据是:_____________________。
(2)以上实验步骤,有一步不够严密,请指出是那一步:______(填步骤序号);该步骤应该做何改进?__________________。
(3)要达到实验目的,还应该再增加一个实验步骤,这个实验步骤是______。
(4)若用另一套实验装置和操作替换第⑤步实验,也可以达到这一步的实验目的,请从图中所给的仪器作出合理选择,将它们连接成一个符合设计者要求的试验装置。
这个实验装置按照气流从左到右的连接顺序是__接__接__接__接__接__。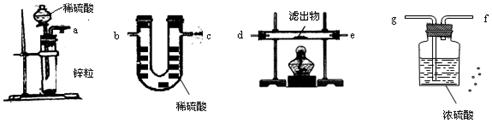
下列框图中的A ~ K物质均为中学常见物质。已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物。A和I都是常用的漂白剂,F的焰色反应呈黄色。F、G均能与L的水溶液反应放出B。请根据图示关系回答问题: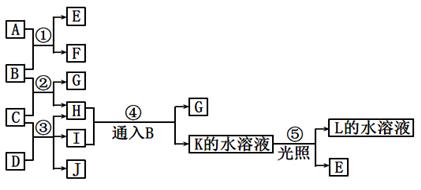
(1)F的俗名是______;K的电子式______。
(2)反应①~⑤中,属于氧化-还原反应的是______。
(3)反应④的离子方程式________________________。
反应③的化学方程式________________________。
(4)某单质能与H反应生成E,该反应的化学方程式为____________。