用双线桥法分析下列反应:
(1)Fe+CuSO4=FeSO4+Cu
(2)Cl2+H2O=HClO+HCl
(3)5NH4NO3 2HNO3+4N2↑+9H2O
2HNO3+4N2↑+9H2O
(4)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
钨是我国丰产元素。自然界中钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)。黑钨矿传统冶炼工艺流程图如下:
(1)已知上述转化中,除最后一步外,W的化合价未发生变化,则产品C的化学式为;如何将其冶炼成单质(用化学方程式表示):。
根据金属的活动性不同,金属的冶炼方法一般有三种。
(2)写出第一步转化中“Mn2+→MnO2”的离子方程式。
(3)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种蓝色的、非整比的钨的氧化物WO(3-x)。这种蓝色氧化钨具有比表面大、易还原的优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种价态的钨,已知x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为。
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表的________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
NaCl+H2O NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下图: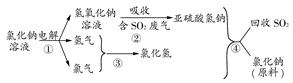
请写出②④的化学反应方程式:________、________。
随着世界粮食需求量的增加,农业对化学肥料的需求越来越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下: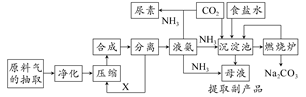
(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在________中进行合成氨。则沿X方向回去的物质是________。
(2)目前生产尿素是以氨气与CO2为原料,发生反应的化学方程式是________、________。
尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是________。
(3)沉淀池中发生反应的化学方程式是________________。
(4)上述生产中的副产品氯化铵长期使用会造成土壤酸化、变硬甚至板结。对土壤的酸碱性进行测定与改良是保护________、提高土壤肥力的有效途径。测定土壤的pH的方法是________。
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?________________________________________________________。
(2)在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:__________________________________________。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?________(填“是”或“否”),是否可以增大该反应放出的热量?________(填“是”或“否”)。
(4)为提高SO3吸收率,实际生产中用________吸收SO2。
(5)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.9 kJ·mol-1,计算每生产1万吨98%的硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空: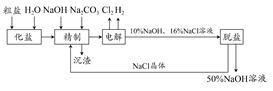
(1)在电解过程中,与电源负极相连的电极上的电极反应式为________________,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是________________________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________。(选填a、b、c)。
a.Ba(OH)2b.Ba(NO3)2c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_______(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却________、(填写操作名称)除去NaCl。