已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA- H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积KW=c 2(OH-) 2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
(3) 已知难溶物CaA在水中存在溶解平衡;CaA(s)
已知难溶物CaA在水中存在溶解平衡;CaA(s)  Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c(Ca2+)________,原因是 。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3。甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_______,通过计算确定上述方案______(填“可行”或“不可行”)。
(每空3分,共15分)原子序数依次增大 的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两
的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两 种氧化物。
种氧化物。 (1)W元素在元素周期表的位置为
(1)W元素在元素周期表的位置为 ,用电子式表示其气态氢
,用电子式表示其气态氢 化物。
化物。 (2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
。 (3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是 。
。
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为。
(每空3分,共12分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下: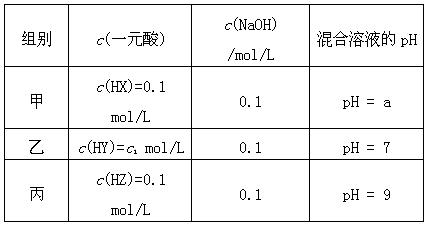
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY为强酸,则HY溶液的pH=。
(3)丙组实验发生反应的离子方程式为,
所得溶液中由水电离出的c(OH-) =mol/L。
(15分)
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下: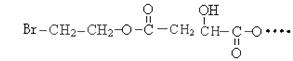
已知加热X与足理的NaOH水溶液反应时,得到A、B、C三种有机物,其中C中含
碳原子最多。室温下A经盐酸酸化可得到苹果酸E,E的结构简式为: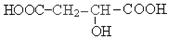
请回答:
(1) B中含有的官能团为。(填名称)
(2)1molX与足量的NaOH水溶液充分反应,消耗NaOH的物质的量为。
(3)C经酸化可得到有机物G,G不能发生的反应类型有(填序号)。
①加成反应②消去反应③氧化反应④取代反应
(4)1 molC酸化后与足量浓溴水充分反应需mol Br2 。
(5) E在浓H2SO4作用下可生成六元环状化合物,其化学方程式为。
(6)E的两种同分异构体F、G有如下特点:1molF或G可以和3molNa发生反应,放出标准状况下33.6LH2,1molF或G可以和足量NaHCO3溶液反应,生成1molCO2,1molF或G还可以发生银镜反应,生成2molAg。则F和G的结构简式分别是、。
(15分)
Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是__________(填序号)
| A.砷化镓晶胞结构与NaCl相同 | B.第一电离能 As>Ga |
| C.电负性 As>Ga | D.原子半径 As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为__________;
(3)AsH3空间形状为___________;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因, Cu2+的核外电子排布式为__________________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有和。
(15分)
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某
些转化步骤及生成物未列出):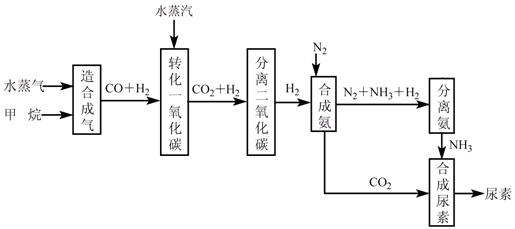
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: ______。
(2)上述流程中,工业上分离H2、CO2合理的方法是___________。
| A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸 |
| B.混合气加压冷却,使CO2液化 |
| C.混合气用氨水洗涤 |
| D.混合气先通入到石灰浆,然后高温煅烧固体, |
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行___________,目的是________________________________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法:。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。