某实验小组用下列装置进行乙醇催化氧化的实验。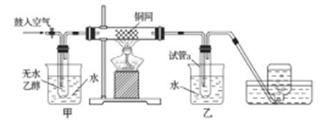
实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、 。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是 反应。甲和乙两个水浴作用不相同。甲的作用是 ;乙的作用是 。
反应进行一段时间后,干燥管a中能收集到不同的物质,它们是 。集气瓶中收集到的气体的主要成分是 。
若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可现在混合液中加入 (填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填试验操作名称)即可除去。
碘在工农业生产和日常生活中有重要用途。
(1)上图为海带制碘的流程图。步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
步骤④发生反应的离子方程式为 。
若步骤⑤采用四氯化碳来提取碘,将四氯化碳加入含碘水溶液并振荡,将观察到的现象是 。
操作⑥可用的方法是: 。
A、加碱洗涤法 B、过滤法 C、萃取分液法 D、蒸馏或分馏法
(2)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟
水反应的方程式为:IBr+H2O==HBr+HIO等,下列有关IBr的叙述中错误的是:
A.跟溴、碘相似,固体溴化碘熔沸点也很低
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(3)为实现中国消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)形式存在。可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,请写出反应的离子方程式:
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
| 实验步骤 |
实现现象 |
反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液。 |
① |
|
| 过滤,往所得滤液中通入过量二氧化碳, |
② |
③ |
| 继续加入过量稀盐酸 |
④ |
II、牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。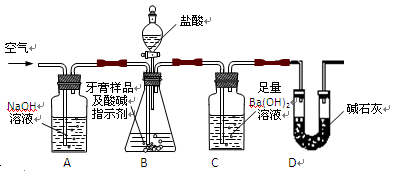
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是:
。
(3)、C中反应生成BaCO3的化学方程式是 。
(4)、下列各项措施中,不能提高测定准确度的是 (填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)、实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为 。
(6)、某同学提出将C中的Ba(OH)2换成浓H2SO4,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下: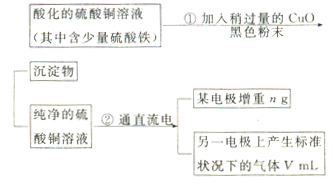
回答下列问题:
(1)加入CuO的作用是。
(2)步骤②中所用的部分仪器如下图所示,则A、B分别连直流电源的和极(填“正”或“负”)。
(3)电解开始后,在U形管中可以观察到的现象有:。电解的离子方程式为。
(4)下列实验操作中必要的是(填写字母)。
(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计算式表示)。
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题: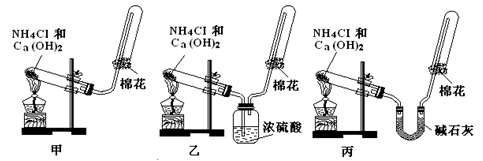
(1)三位同学制取氨气的化学方程式为:
_____________________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是____________________________.
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是___________填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是_________(填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替制备NH3?____________(填“能”或“不能”)。
(12分)实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取w g该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。回答下列问题: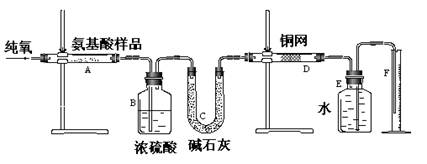
(1)实验开始时,首先通入一段时间的氧气,其理由是_;
(2)以上装置中需要加热的仪器有______(填写字母),操作时应先点燃________处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________________________。
(4)D装置的作用是。
(5)实验中测得氮气的体积为V mL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有___。
| A.生成二氧化碳气体的质量 | B.生成水的质量 |
| C.通入氧气的体积 | D.氨基酸的相对分子质量 |