农业生产上常需要用质量分数为12%的氯化钠溶液选种。下图是小军实验操作过程示意图:
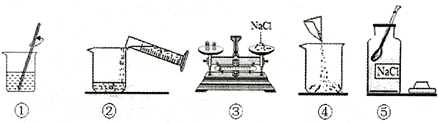
(1)图中一处明显错误的操作是 (填序号),改正操作后,用上述图示的序号表示配制溶液的正确操作顺序 。
(2)现配制100kg这种溶液,需氯化钠 kg;
(3)现用质量分数为12%的氯化钠溶液(密度约为l.09g/cm3),配制50g质曼分数为6%的氯化钠溶液。需要质量分数12%的氯化钠溶液 mL(计算结果精确到0.l),需要水 mL(水的密度为1g/cm3)。
(4)20℃时,向50g水中加入20g氯化钠,充分溶解后,得到溶液的质量为68g,则20℃时,氯化钠的溶解度为 g.
如图,某同学做乙醇氧化实验时将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰的a,b两点时现象明显不同,请写出a,b两点的实验现象,并解释产生该现象的原因.
| 实验现象 |
解 释 |
|
| a |
||
| b |
(16分)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:
(1)定性分析
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
②请你设计一个简单的实验方案,确认样品中含有CO32—离子。
(2)定量分析
该小组同学设计了下图所示装置,测定天然碱的化学组成。
A B C D E
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是。
A处碱石灰的作用是。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为 87.6g,装碱石灰的U型管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶质量为88.5g;装碱石灰的U型管D的质量为75.8g。该步骤中缓缓鼓入空气数分钟的目的是
。
计算推导:
该天然碱的化学式为。
(6分)(1)指出下列实验用品或仪器(已经洗涤干净)使用时的第一步操作:
①石蕊试纸(检验气体性质);
②容量瓶。
(2)下列有关化学实验操作中“先”与“后”的说法正确的是(填代号)。
| A.用排水法收集气体后,先移出导管,后撤酒精灯 |
| B.给试管加热时,先均匀加热,后局部加热 |
| C.碱液流到桌子上,先用稀醋酸溶液中和,后用水洗 |
| D.浓硫酸不慎洒到皮肤上,先迅速用水冲洗,后涂上3%-5%的NaHCO3溶液 |
E.点燃可燃性气体(如H2、CO、C2H4等)时,都要先检验气体纯度,后点燃
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,对反应速率有影响,,反应速率越快,能表明同一规律的实验还有(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);
(3)本实验中影响反应速率的其他因素还有,其实验序号是;
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
。
(一)某同学在一只烧杯里装入一定量的纯铁粉,加入200mL 6mol/L的硝酸,铁粉恰好溶解,请探究产物中铁元素价态:
(1)提出假设:
假设1:产物只有+2价铁;
假设2:___________________________________;
假设3:___________________________________。
(2)设计实验:取反应所得溶液分别装入甲、乙两支试管,在甲中滴加酸性KMnO4溶液;在乙中滴加KSCN溶液,观察现象,推测实验现象与结论:
①若现象为____________________,则假设1正确;
②若现象为____________________,则假设2正确;
③若现象为____________________,则假设3正确。
(二)、氯化铁是常见的水处理剂,工业上制备无水FeCl3的流程为:
(3)吸收剂X为FeCl2溶液,其与尾气Cl2反应的离子方程式__________________。
(4)称取上述样品m克溶于25mL稀盐酸,用蒸馏水配成50mL溶液,加入稍过量的KI溶液充分反应: ,用淀粉作指示剂,用
,用淀粉作指示剂,用 溶液进行滴定
溶液进行滴定 ,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56 Cl:35.5)
,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56 Cl:35.5)
(5)用FeCl3溶液(32%-35%)腐蚀铜板电路时所得废液含FeCl3、FeCl2和CuCl2,若用化学方法回收废液中的铜,简述操作要点:___________________________________________________。