按要求填空。
Ⅰ:已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________
Ⅱ:硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因____________如何才能用热水配制出澄清的较浓的CuSO4溶液____________________;
稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的反应___________________________
III:依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品15.2g,配成100 mL待测溶液②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸③将0.1 mol•L-1的KMnO4溶液装入滴定管中,调节液面至8.00mL处④滴定待测液至滴定终点时,滴定管的液面读数18.00 mL如何知道滴定到达终点?
下列操作会导致测定结果偏低的是
| A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定 |
| B.锥形瓶用蒸馏水洗涤后未用待测液润洗 |
| C.读取标准液读数时,滴定前平视,滴定到终点后俯视 |
| D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
下列每种量器的数量不限,在上述实验中,必须使用的有
| A.托盘天平 | B.量筒 |
| C.碱式滴定管 | D.酸式滴定管 |
E. 容量瓶FeSO4的质量分数为
肉桂醛(C9H8O)是一种常用香精,在食品、医药化工等方面都有应用。肉桂醛与其他有机物具有如下转化关系,其中A为一氯代烃。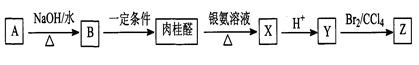
(1)肉桂醛是苯的一取代物,与H2加成的产物中没有支链,肉桂醛结构简式是。
(2)反应A→B的化学方程式是________________________________。
(3)Z不能发生的反应类型是(填字母)___________。
a. 取代反应 b. 加聚反应 c. 加成反应 d. 消去反应
(4)Y与乙醇在一定条件下反应的化学方程式是:____________________。
(5)写出符合下列条件的Y的一种同分异构体的结构:______________________________。
①属于酯类②苯环上只有一个取代基③能发生银镜反应。
医药阿斯匹林的结构简式如下,试根据阿斯匹林的结构回答: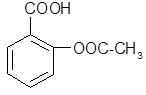
⑴阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B 两种物质。其中A的结构简式为 ,则B的结构简式为;B中含有的官能团是。
,则B的结构简式为;B中含有的官能团是。
⑵阿斯匹林跟小苏打同时服用,可使上述水解产物A与小苏打反应,生成可溶性盐随尿液排出,该反应的化学方程式为:。
⑶上述水解产物A与氢氧化钠溶液反应的化学方程式为;
⑷上述水解产物B与乙醇、浓硫酸共热反应的化学方程式为:;
本题包括A、B两小题,请选定其中一小题并在相应的答
题区域内作答。若多做,则按A小题评分。
A.【物质结构与性质】
元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中 键与
键与 键的个数比为
键的个数比为
。
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)
。
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是
。
(5)C、N两元素形成的化合物 形成的原子晶体,结构类似
形成的原子晶体,结构类似
金刚石,甚至硬度超过金刚石,其原因是。
(6)右图为石墨晶胞结构示意图,该晶胞中含有C原子的个数为。
B.【有机化学基础】
扑热息痛(学名对乙酸氨基酚)是生活中常用到的一种解热镇痛药。以苯为原料合成扑热息
痛的部分转化如下:
请回答下列问题:
(1)B C的反应类型为,D中官能团的名称为。
C的反应类型为,D中官能团的名称为。
(2)C的结构简式为。
(3)1mol扑热息痛与足量 溶液反应,理论上消耗
溶液反应,理论上消耗 的物质的量为mol。
的物质的量为mol。
(4)实验证明B能够与溴水反应,试写出其反应的化学方程式。
(5)扑热息痛有多种同分异构体,同时符合下列要求的同分异构体有种。
①苯环上有两个对位取代基;②同于氨基酸。
甲醇( )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。
(1)利用工业废气中的 可制取甲醇,其反应为:
可制取甲醇,其反应为:
常温常压下已知下列反应的能量变化如图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 的
的  晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应为。
离子。电池工作时正极反应为。
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成 ,然后以
,然后以 做氧化剂把水中的甲醇氧化成
做氧化剂把水中的甲醇氧化成 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式;
②除去甲醇的离子反应为:
 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L 时,共转移电子mol。
时,共转移电子mol。
研究化学反应原理对于生产、生活及环境保护具有重要意义。
(1)工业制硫酸的过程中存在反应: 。
。 ℃时,将2mol
℃时,将2mol 和1.5 mol
和1.5 mol 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中 的物质的量随温度变化的曲线如图所示。
的物质的量随温度变化的曲线如图所示。
①图中a点的正反应速率(填写“>”“<”或
“=”)逆反应速率。
②下列条件可以证明上述反应已经达到化学平衡状态的是 (填写序号)
a.单位时间内消耗1mol ,同时生成2mol
,同时生成2mol
b.容器内 、
、 、
、 的浓度之比为2∶1∶2
的浓度之比为2∶1∶2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
③ ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。
(2)碳酸铵是一种常用的铵态氮肥,其水溶液显碱性,其原因是;溶液中离子浓度关系为 。
。
(3)治理水体重金属离子污染时,首先投入沉淀剂将重金属离子转化为难溶悬浮物,然后再投入氯化铝将污水中的悬浮物除去,从而净化水体,氯化铝的作用是
(用离子方程式表示)。