下图装置堪称多功能电化学实验装置。下列有关此装置的叙述中,不正确的是( )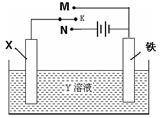
| A.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| B.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
| C.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| D.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动 |
已知热化学方程式:
SO2(g)+1/2O2(g) SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
| A.196.64 kJ | B.196.64 kJ/mol | C.<196.64 kJ | D.>196.64 kJ |
下列热化学方程式书写正确的是
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3 kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ/mol(反应热) |
| D.2NO2===O2+2NO ΔH=+116.2 kJ/mol(反应热) |
下列说法或表示法正确的是
| A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 |
| B.需要加热的反应说明它是吸热反应 |
| C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4 的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| D.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2===SO2 ΔH=-297.3 kJ/mol |
关于化学反应与能量的说法正确的是
| A.中和反应是吸热反应 | B.燃烧属于放热反应 |
| C.化学键断裂放出能量 | D.反应物总能量与生成物总能量一定相等 |
下列有关化学反应速率的说法正确的是
| A.凡是能量达到活化能的分子发生的碰撞均为有效碰撞 |
| B.增大反应物浓度能加快正反应的反应速率,降低逆反应的反应速率 |
| C.温度升高使化学反应速率加快的主要原因是增加了反应物分子之间的碰撞次数 |
| D.决定化学反应速率的根本因素是参加反应的各物质的性质 |