下列热化学方程式书写正确的是
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3 kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ/mol(反应热) |
| D.2NO2===O2+2NO ΔH=+116.2 kJ/mol(反应热) |
在一定条件下,RO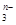 和氟气可发生如下反应:RO
和氟气可发生如下反应:RO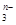 +F2+2OH-
+F2+2OH- RO
RO +2F-+H2O从而可知在RO
+2F-+H2O从而可知在RO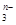 中,元素R的化合价是
中,元素R的化合价是
| A.+4 | B.+5 | C.+6 | D.+7 |
质量分数为a%,物质的量浓度为c mol·L-1的KOH溶液,蒸发溶剂,恢复到原来的温度,若质量分数变为2a%,则物质的量浓度变为
| A.等于2c mol·L-1 | B.大于2c mol·L-1 |
| C.小于2c mol·L-1 | D.在c~2c mol·L-1之间 |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
| A.甲的分子数比乙的分子数多 | B.甲的物质的量比乙的物质的量少 |
| C.甲的摩尔体积比乙的摩尔体积小 | D.甲的相对分子质量比乙的相对分子质量小 |
NA代表阿伏加德罗常数,下列叙述错误的是
| A.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数小于9.8% |
B.在H2O2+Cl2 2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 |
| C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D.NA个一氧化碳分子和0.5mol甲烷的质量比为7:2 |
下列离子方程式中,正确的是
A.氨气通入醋酸CH3COOH+NH3=CH3COO-+NH |
| B.碳酸氢镁溶液中加过量石灰水 Mg2++2HCO  +Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ +Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ |
| C.澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O |
D.少量CO2通入NaOH溶液中CO2+OH-=HCO +H2O +H2O |