下列各组元素的性质递变情况错误的是
| A.Li、Be、B原子最外层电子数依次增加 | B.P、S、Cl 元素最高正化合价依次升高 |
| C.N、O、F原子半径依次增大 | D.Na、K、Rb的金属性依次增大 |
将100mL1 mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中碳酸根离子浓度的变化分别是
| A.减小、减小 | B.减小、增大 | C.增大、增大 | D.增大、减小 |
下列事实中,能证明氯化氢是共价化合物的是
| A.氯化氢易溶于水 | B.氯化氢的水溶液能导电 |
| C.液态氯化氢不导电 | D.氯化氢不易分解 |
下列说法正确的是
A.常温下,反应C(s)+CO2(g)  2CO(g)不能自发进行,则该反应的ΔH>0 2CO(g)不能自发进行,则该反应的ΔH>0 |
| B.自发反应的熵一定增大,非自发反应的熵一定减小 |
| C.凡是放热反应都是自发的,因为吸热反应都是非自发的 |
| D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0 |
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)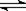 Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4的反应为放热反应
B.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正>v逆
C.25 ℃时反应Ni(CO)4(g) 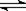 Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
稀氨水中存在着下列平衡:NH3·H2O NH+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是
NH+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
| A.①②③⑤ | B.③⑥ | C.③ | D.③⑤ |