某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ________________ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。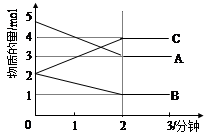
铁路提速为鲜活水产品、新鲜水果和蔬菜的运输提供了有利条件。在鲜活鱼的长途运输中,必须考虑以下几点:水中需要保持适量的O 2 ;及时除去鱼排出的CO 2 ;防止细菌的大量繁殖。现有两种在水中能起供氧灭菌作用的物质,其性质如下:
过氧化钠(Na2O2):易溶于水,与水反应生成NaOH和O2;
过氧化钙(CaO2):微溶于水,与水反应生成Ca(OH)2和O2。
根据以上介绍,你认为运输鲜活水产品时选择哪种物质加入水中更好?原因是___________________________________________________。
聚苯乙烯快餐盒、一次性塑料包装袋和聚氯乙烯农用地膜被视为危害环境的三大“白色公害”。为解决一次性快餐盒所带来的“白色污染”问题,国家已于2000年11月禁止使用泡沫塑料饭盒,取而代之的是用纸浆、植物纤维等易循环利用原料制成的一次性“纸饭盒”。据报道,德国Danone公司现已开发出的六十天能自行降解的绿色食品盒(杯)——聚乳酸(分子式为C 3n H 4n+2 O 2n+1 ,分子结构中含有支链)包装材料。为解决农用地膜所带来的“白色污染”问题,我国武汉大学张俐娜教授提出了“以甘渣浆、麦秆、芦苇浆”为原料来生产“再生纤维素共混膜”的研究课题,已获成功。使用“共混膜”不但能使农作物增产20%,而且使用到最后,其成分的30%可被微生物吃掉,剩余部分也会在40天内自动降解,对土壤无副作用。请完成下列问题:
(1)人为因素引起的环境问题主要有两大类:一是生态破坏;二是_______。
| A.环境污染 | B.水土流失 |
| C.土地沙漠化 | D.水质差,缺水 |
(2)环保专家预言,废弃的地膜最终将成为祸害,你认为会造成什么祸害?
(3)有人建议焚烧处理这些一次性快餐盒和农用地膜等普通塑料废弃物,你认为是否可行?为什么?
(4)张俐娜教授的研究课题有什么积极的环保意义?
(5)德国公司生产的绿色食品杯所用的原料乳酸可以从甜菜发酵的糖液中提取,然后通过_______反应可生成聚乳酸。聚乳酸的降解可分为两个阶段:首先是纯化学反应水解成乳酸单体,然后是乳酸单体在微菌的高温下分解生成二氧化碳和水。这两步反应的化学方程式为___________________,___________________。
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按图所示进行实验: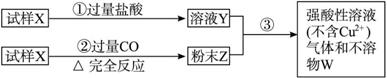
(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为______________(用m表示)。
大家都知道 6月1日 是国际儿童节,但或许绝大多数人并不了解这天同时也是“世界牛奶日”。20世纪50年代,法国的促进牛奶消费协会提出了庆祝“牛奶日”的设想,并做出了每年5月第三周的周二为“国际牛奶日”的决定,2000年经联合国粮农组织(FAO)的提议,兼顾到某些国家已经确定的日期,并征得了世界700多位乳业界人士的意见,把每年的 6月1日 确定为“世界牛奶日”。人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体〔Ca 10 (PO 4 ) 6 (OH) 2 〕形式存在。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
(1)羟基磷酸钙中钙元素的质量分数为__________(保留到 0.1 g )
(2)包装标签上脂肪≥ 3.3 g ,是指100 mL牛奶中含脂肪至少 3.3 g 。那么一盒牛奶中含钙至少__________g。(保留到 0.01 g )
有一瓶无色气体,可能含H2S、CO2、HCl、HBr、SO2中的一种或几种。将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的BaCl2溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的AgNO3溶液,产生了白色沉淀。据此推断:肯定有__________,肯定没有__________,无法确定的是__________。