锰、铝、铁、钠的单质及其化合物在工业生产中有着广泛应用。请回答下列问题:
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示) 。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
(2)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X。取少量X溶液两份,一份加入KSCN 溶液时,溶液显红色;另一份中加入黄色铁氰化钾 (K3[Fe(CN)6])溶液后能发生复分解反应生成蓝色沉淀。已知:K3[Fe(CN) 6]的电离方程式为K3[Fe(CN)6]= 3K++[Fe(CN) 6]3-。请分析:
①用化学方程式表示产生两种金属阳离子的原因 。
②蓝色沉淀是由铁氰化钾与低价态阳离子反应的结果,试写出该反应的离子方程式 。
(3)将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化。
请完成下列问题:
①反应过程中共得到的气体的体积为 (标准状况);
②最终是否有沉淀产生? (填“是”或“否”),若有沉淀产生,其质量为 。 (若不存在,则不必回答第(2)问)
盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)①在100mL 1 8 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
| A.40.32L | B.30.24L | C.20.16L | D.6.72L |
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若 不可行,请说明原因。若可行,请写出反应的离子方程式:。
不可行,请说明原因。若可行,请写出反应的离子方程式:。
(2)若将6.4g铜粉与一定量浓硝酸反应,当铜粉完全溶解时,生成气体(NO、NO2)共2.24L(标准状况),则反应中所消耗的硝酸的物质的量为。
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为:。
铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下图所示,请回答有关问题: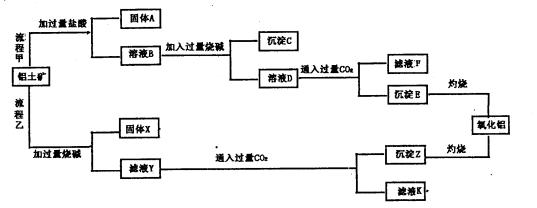
(1)流程乙加入烧碱后发生反应 的离子方程式:.
的离子方程式:.
(2)溶液D到沉淀E发生的离子方程式:。
(3)验证滤液B含Fe3+,可取少量滤液并加入。
(4)滤液K中溶质的主要成份是(填化学式)。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题: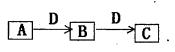
(1)若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B转化为C的化学方程式是:。
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶 液,产生不溶于稀硝酸的白色沉淀,则B的化学式是。
液,产生不溶于稀硝酸的白色沉淀,则B的化学式是。
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是:。
符合条件的D物质可能是(填序号):
①硫酸②醋酸⑨氢氧化钠④一水合氨⑤氯化钡
某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):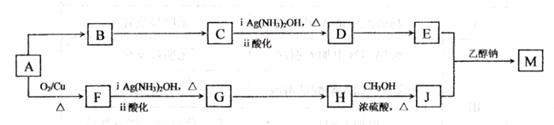
已知:①的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3:1。
②ROOCCH2COO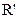 +CH2=CHCOO
+CH2=CHCOO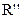
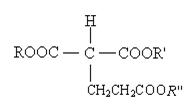
(R、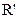 、
、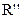 代表相同或不相同的烃基)
代表相同或不相同的烃基)
(1)A分子中的含氧官能团的名称是______________________。
(2)D→E反应的化学方程式是____________________。
(3)A→B反应所需的试剂是_______________。
(4)G→H反应的化学方程式是____________。
(5)已知1mol E与2 mol J反应生成1 mol M,则M的结构简式是__ _________。
_________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有_____种,其中任意1种的结构简式是___________。
(7)J可合成高分子化合物,该高分子化合物结构简式是_________ __。
__。
有关FeSO4的转化关系如下图所示(无关物质已略去)。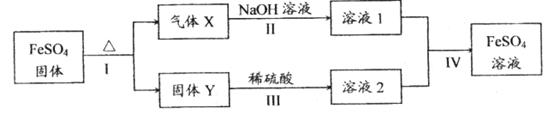
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红综色的化合物。
(1)气体X的成分是(填化学式)_____________。
(2)反应I的反应类型属于(填序号)______________。
a. 分解反应 b. 复分解反应 c. 置换反应 d. 化合反应 e. 氧化还原反应
(3)溶液2中金属阳离子的检验方法是_______________。
(4)若经反应I得到16g固体Y,产生的气体X恰好被0.4L 1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是__________ __。
__。