1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )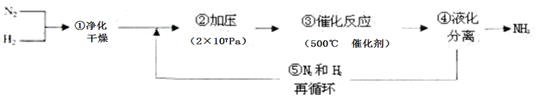
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
1997年,英国的“克隆羊”备受世界关注。“克隆羊”的关键技术之一是找到一些特殊的酶,这些酶能激活普通体细胞使之像生殖细胞一样发育成个体。有关酶的叙述错误的是
| A.酶是具有催化作用的蛋白质 | B.酶只有在强酸或强碱性条件下才能起作用 |
| C.高温或重金属盐能降低酶的活性 | D.酶的催化作用具有选择性和专一性 |
生命起源的研究是世界性科技领域的一大课题,科学家模拟和十亿年前地球的还原性大气环境进行紫外线辐射实验(当时无臭氧层),认为生命起源的第一层次是产生了与硝基化合物可能是同分异构体的
| A.醇类 | B.羧酸类 | C.糖类 | D.氨基酸 |
甲醛、乙醛,丙醛的混合物中,测得H的质量分数为9%,则混合物中O的质量分数
| A.37% | B.16% | C.6.6% | D.无法确定 |
季戊四醇[(CH2OH)4C]是一种有广泛应用的有机化工原料。下列说法中正确的是
| A.季戊四醇在工业上可以由乙醛和过量甲醛通过羟醛缩合反应制取 |
| B.季戊四醇可以发生消去反应生成对应的烯烃 |
| C.季戊四醇可以发生催化氧化生成对应的醛 |
| D.季戊四醇最多可以和2mol乙酸发生酯化反应 |
丙烯醛的结构简式为CH2=CH—CHO,下列关于它的性质的叙述中,正确的是
| A.能使溴水和KMnO4溶液褪色 | B.在一定条件下与H2充分加成生成丙醛 |
| C.能被新制Cu(OH)2悬浊液所氧化 | D.能发生银镜反应,表现出氧化性 |