(13分)(1)A、B、D为短周期元素,请根据信息回答问题:
| 元素 |
A |
B |
D |
| 性质或结构信息 |
工业上通过分离液态空气获得其单质,单质能助燃 |
气态氢化物的水溶液显碱性 |
原子有三个电子层,简单离子在本周期中半径最小 |
①第一电离能:A B(填“>”、“=”、“<”),基态D原子的电子排布式为 。
②B和D由共价键形成的某化合物BD在2200℃开始分解,BD的晶体类型为 。
(2)发展煤的液化技术被纳入“十二五规划”,中科院山西煤化所关于煤液化技术的高效催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH),从而实现液化。
①某含铜离子的离子结构如右图所示: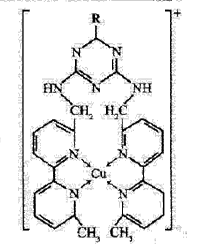
在该离子内部微粒间作用力的类型有: (填字母)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.范德华力 F.氢键
②煤液化获得甲醇,再经催化得到重要工业原料甲醛(HCHO),甲醇的沸点为65℃,甲醛的沸点为-21℃,两者均易溶于水。甲醇的沸点比甲醛高是因为甲醇分子间存在着氢键,而甲醛分子间没有氢键。甲醇和甲醛均溶于水,是因为它们均可以和水形成分子间氢键。请你说明甲醛分子间没有氢键的原因是 。
③甲醇分子中,进行sp3杂化的原子有 ,甲醛与H2发生加成反应,当生成1mol甲醇时,断裂的∏键的数目为
超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有__________。(填字母序号)
| A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子 |
| C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素 |
| D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体 |
(2)NH4CuSO3中的金属阳离子的核外电子排布式为_______________。
(3)SO2–3 离子中S硫原子的杂化方式为________,与其互为等电子体的一种分子的分子式是___________。
(4)NH3易液化的原因是___________________。
(5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式_____。
(6)NH4CuSO3与硫酸微热反应的离子方程式为__________________________。
(14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
|||||||||||||||||
| B |
C |
D |
E |
F |
|||||||||||||
| G |
H |
I |
J |
K |
L |
||||||||||||
| M |
N |
||||||||||||||||
试回答下列问题:
(1)请写出元素N的基态原子电子排布式________________________________。
(2)元素B、G形成的单质熔点更高的是______________(填化学式),原因是____________________
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是__________(填“极性”或“非极性”)分子。
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为_____________________。
在150ml 0.2mol/L 硫酸铜溶液中插入两个电极,通电电解(不考虑水蒸发)。
(1)若两极均为铜片,试说明电解过程中浓度将怎样变化。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是。
(3)如不考虑氢离子在阴极上放电,当电路中有0.04mol e-通过时,阴极增重g,阴极上的电极反应式是。
23.已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
⑴铅蓄电池在放电时的负极反应为,其在充电时阳极反应为;
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为;
⑶上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是;
⑷如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4mol。
等质量的铜、锌、铁三种金属混合物A克加入FeCl3和盐酸之中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有,可能有;(2)若剩余固体为A/3克,则溶液中的阳离子一定有,可能还有,一定没有;
(3)若剩余固体为3A/4克,则溶液中的阳离子一定有,一定没有。