A、B、C、D、E五种短周期元素,A、B同主族,C、D同周期,B、E同周期。气体A2与气体C2混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体。B、C、E简单离子的核外电子排布相同。E的最高价氧化物可与B的最高价氧化物的水化物反应生成一种易溶于水的的盐,D能形成自然界硬度最大的单质。请根据上述所提供的信息回答下列问题。
(1)写出A、B两种元素的元素名称:A________、B________;D在周期表中的位置是________;写出D的最高价氧化物的电子式 。
(2)写出由B和C两元素形成的原子个数比为1:1的化合物F的电子式 ,其存在的化学键是 、
(3)写出F和A2C反应的离子方程式:__________________________ __。
(4)用电子式表示B2C形成的过程:_____________________ _________________________。
(5)请写出E的最高价氧化物与B的最高价氧化物的水化物反应的离子反应方程式
已知X、Y、Z为三种由短周期元素构成的粒子,每摩粒子都有10mol电子,其结构特点如下:
| X |
Y |
Z |
|
| 原子核数 |
单核 |
四核 |
双核 |
| 粒子的电荷数 |
1个单位正电荷 |
0 |
1个单位负电荷 |
现有A、B、C、D、E、F、G、H、I、J、K等物质,它们之间的相互反应转化关系如下图所示下图所示:
已知物质A由X、Z构成, B、C、D、K都是单质,G为无色液体,I的水溶液呈碱性,反应①~⑤都是用于工业生产的反应,请回答下列问题:
(1) A的电子式为;D的结构式为。
(2)物质B的组成元素在元素周期表中的位置是。
(3)反应①的化学方程式为。
反应④离子方程式为。
(4)H和I反应的生成物的水溶液呈酸性,其原因是(用一个离子反应方程式表示)
(5)已知每生成1mol I放出46.0kJ的热量,则反应③的热化学方程式为。
某实验小组欲测定KMnO4的分解率α,但加热前忘记称量KMnO4的质量。面对此情况,甲同学采用下述方法:在加热时,利用浓盐酸与KMnO4受热部分分解后所得的固体混合物反应产生的Cl2被碱石灰吸收,通过碱石灰增重来计算KMnO4的分解率α。(与热的浓盐酸反应时,固体混合物中的Mn元素均被还原成Mn2+)
取KMnO4受热部分分解后所得的固体混合物mg进行实验,请从上图中选用所需的仪器(可重复选用)组成一套反应装置,其它固、液试剂自选。(其中某些连接和固定仪器用的
玻璃管、胶管、铁夹、铁架台及加热装置、打气筒等均略去)
(1)在反应发生前,为了消除装置内空气中酸性气体的影响,须用打气筒向装置内鼓入一定量的空气。请你在下表中填写完成本实验时各装置的连接次序及药品。
| 各装置连接次序 |
A |
C |
C |
|||
| 对应的药品 |
d:浓盐酸 e:固体混合物 |
碱石灰 |
碱石灰 |
(2)上述高锰酸钾受热部分分解后所得固体混合物中K2MnO4与MnO2物质的量之比是。
(3)当A装置内反应结束后,关闭分液漏斗活塞,打开止水夹k,再一次用打气筒向装置内鼓入一定量空气,其目的是。
(4)若测得碱石灰增重ng。为了计算KMnO4的分解率α,该同学采用方法如下:设原mg的固体混合物中KMnO4及MnO2的物质的量分别为x、y,依据实验数据m及n,可列出三个含x、y、α的等式,请你写出这三个等式。(注意:等式中不用带单位)
仅含m、x、y的等式①:m=。
仅含n、x、y的等式②:n=。
仅含α、x、y的等式③:α=。
(5)另一同学设计更为简单的方法(无须化学反应)也可测定KMnO4的分解率α。
该同学的方法是:称取一定量KMnO4受热部分分解后所得的固体混合物,置于盛有适量蒸馏水的烧杯中,充分搅拌,再进行“一系列实验操作”并记录实验数据,最后经计算,即可得出KMnO4的分解率α。该同学的“一系列实验操作”是指。
将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:
KMnO4+HCl -KCl+MnCl2+Cl2↑+H2O
(2)上式反应中的还原剂是,当还原剂失去1mol电子时,氧化产物的物质的量为。
(3)a +b的最大值为,a +b最小值为。
(4)当 a +b =0.18时,残留固体的质量为。
【化学—有机化学基础】(15分)
某有机化合物A的结构简式如图,回答下列问题: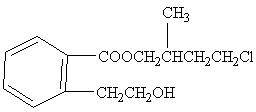
(1)A的分子式为。
(2)A在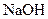 水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是。
水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是。
(3)B与足量的某饱和一元羧酸D充分反应后生成E,E和B的相对分子质量之差为84,则D的摩尔质量为。
(4)C酸化后可得F,F不能发生的反应类型是(填写字母代号)。
a.取代反应 b.加成反应 c.消去反应 d.加聚反应 e.缩聚反应 f.还原反应
(5)F可以发生如下转化,且G与H互为同分异构体。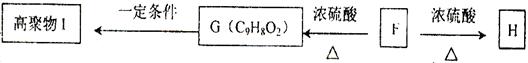
请写出:①H的结构简式。②由F生成G的化学方程式。
(6)符合下列三个条件的F的同分异构体的数目有个。(不包括F)
①含有邻二取代苯环结构②与F具有相同的官能团③不与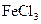 溶液发生显色反应
溶液发生显色反应
【化学—物质结构与性质】
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。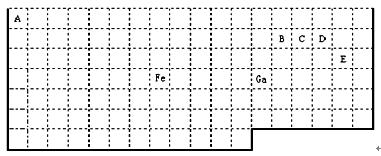
根据信息回答下列问题:
(1)周期表中比Ga质子数少2的基态原子价电子排布式为。
(2)Fe元素位于周期表的分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 ____和 _____(填化学式),CO的结构式为 。
(3)在CH4、CO及CH3OH中,碳原子采取sp3杂化的分子为 。
(4)根据VSEPR理论预测ED4- 离子的空间构型为______________型。B、C、D及E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:__________________________________(写2种) 。
(5)B与D形成的稳定化合物为___________分子(填“极性”“非极性”),其固态为 ________晶体。