有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。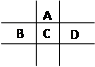
回答下列问题:
(1)A原子结构示意图 。
(2)B的最高价氧化物的水化物的化学式为 ,
C的元素名称为 ,
A、C、D、E四种元素形成的简单离子的半径大小顺序为(用离子符号表示) (3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
,
有关反应的离子方程式为
某化合物XY2中,各离子的电子层结构相同,且核外电子总数为54。则XY2的化学式为___________,电子式为_____________。
在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2进行可逆反应:
2SO2(g)+ O2(g) 2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
(1)2 min内,SO2的物质的量减少了,SO3的物质的量增加了;
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=;
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=。
有A、B、C、D、E五种金属元素,在相同的条件下,B的最高价氧化物对应的水化物的碱性比A的最高价氧化物对应的水化物的碱性强,A、B都可以从盐溶液中置换出C;D与冷水剧烈反应并放出氢气,A、B、C、E四种金属分别投入到盐酸中,只有E不放出氢气,则这五种金属元素的金属性由强到弱的顺序为
向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.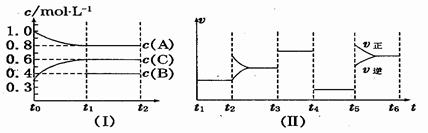
请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为。
(2) t4~t5阶段改变的条件为,B的起始物质的量浓度为,各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
则K1=(保留两位小数),
K1、K2、K3、K4、K5之间的关系为(用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为.
现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:②④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH7 (填“>”“<”或“:”).,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
| A.c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—) |
B.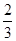 c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3) c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3) |
| C.c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+) |
| D.c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+) |