在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题:
2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题: (1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1
(1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1
(2)在图中画出SO3的物质的量浓度随时间的变化曲线。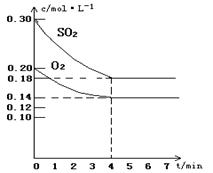
(3)在其他条件不变,7min时分别改变下列条件,将改变条件的瞬间正、逆反应速率的变化情况(“增大”、“减小”或“不变”)填入下表空格内:
| 改变的条件 |
V正 |
V逆 |
| ①增大O2的浓度 |
增大 |
|
| ②减小SO3的浓度 |
|
减小 |
| ③缩小容器的体积 |
增大 |
|
| ④加入V2O5作催化剂 |
增大 |
|
| ⑤压强不变充入He气体 |
|
减小 |
同温同压下,等体积的CO和CO2的物质的量之比________,质量比________,密度比________,所含氧元素的质量比________。
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成: Al2O3+N2+3C==2AlN+3CO
(1)在这个反应中,氧化剂是_____________, 还原剂是____________
(2)标出该反应中电子转移的方向和数目_________________________________
碘元素的一种核素12553I可用于治疗肿瘤。该核素的质子数为_____________,中子数为__________,质量数为__________,核外电子数为___________.
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 。
(3)由N2O和NO反应生成N2和NO2的能量变化如下图所示, 若生成1molN2,计算该过程的△H= kJ·mol-1。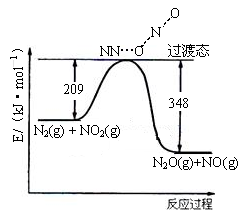
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
① 一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L,b mol/L,则SO2 起始物质的量浓度为_________mol/L;生成SO3的化学反应速率为__________mol/(L • min)。
②工业制硫酸,尾气SO2用__________吸收。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示: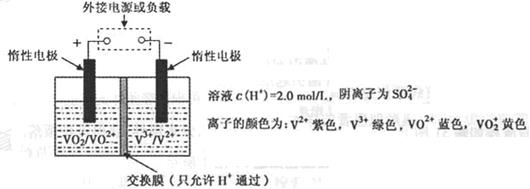
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为 。