(1)H218O和D2O分子中的中子数,前者和后者的关系是 (填序号,下同)
a.大于 b.小于 c.等于 d.无法确定
(2)化学变化中,可能发生改变的是
a.质子数 b.中子数 c.核外电子数 d.原子核
(3)右图为周期表的一部分,已知A,B,C,D,E五种元素,原子核外共有85个电子,E原子核外有四个电子层,B元素是 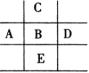
a.P b.Mg c.Cl d. Si
(1)0.25 mol某固体A的质量是15 g,A的相对分子质量为 。
(2)在同温、同压、同体积的条件下,H2与气体A的质量之比是1∶8,A的摩尔质量为 。
(3)在25℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,A的摩尔质量为 。
(4)两个同容积的密封容器A、B,在25℃下,A中充入ag A气体,B中充入ag CH4气体,A与B内的压强之比是4∶11,A的摩尔质量为 。
(5)在同温、同压下,相同体积的CH4与气体A的密度之比为1∶4,A的摩尔质量为 。
某双原子分子构成的气体,其摩尔质量为Mg·mol-1,该气体质量为mg,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为 mol。
(2)该气体在标准状况下的体积为 L。
(3)该气体在标准状况下的密度为 g·L-1。
(4)该气体所含原子总数为 个。
(5)该气体的一个分子的质量为 g。
)在标准状况下,①6.72 L CH4气体;②3.01×1023个HCl气体分子;
③13.6 g H2S气体;④0.2 mol NH3,按下列要求对这四种气体的关系从大到小进行排列(用上述数字序号表示):
(1)标准状况下四种气体的体积 。
(2)四种气体的质量 。
(1)相同物质的量的CO2和O2,原子数目之比为 ,氧原子数目之比为 ;质量相同的CO2和O2,其物质的量之比为 。
(2)20.6 g NaR含有Na+0.2 mol,则NaR的摩尔质量为 g·mol-1,则含R 8.0 g的NaR的物质的量为 mol。
(1)3 mol KClO3完全分解,生成氧气的物质的量为 mol,其质量为 g。
(2) mol Zn和足量的HCl反应,生成氢气1.5 mol。
(3)与5.1 g某二元酸H2R完全反应,刚好消耗NaOH的质量为12 g,则H2R的摩尔质量为 。