分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题: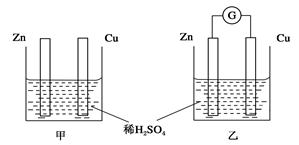
(1)以下叙述中,正确的是__________。
| A.甲中锌片是负极,乙中铜片是正极 |
| B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 |
| D.产生气泡的速度甲中比乙中慢 |
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是__________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式_________________
(14分)使用如图所示装置进行化学小实验,请填写下列空白:
(1)若①中放一片湿润的红色石蕊试纸,②装有浓氨水,可观察到的实验现象为。
(2)若①装有AlCl3溶液,②装有浓氨水,可观察到的实验现象为,反应的离子方程式为。
(3)若①装有浓硝酸,②装有浓氨水,可观察到的实验现象为,反应的化学方程式为。
(4)若①装有浓硝酸,②装有Na2SO3溶液,实验时有无色气体产生,该气体逐渐变为红棕色,用化学方程式表示无色气体变为红棕色的原因,写出浓硝酸和Na2SO3溶液反应的离子方程式 。
按要求回答下列问题:
(1)下列事实反映了硫酸、硝酸的什么性质:
①实验室用锌粒和稀硫酸反应制取氢气;
②浓硫酸能使胆矾晶体由蓝变白;
③浓硫酸使纸张变黑;
④硝酸溶解金属铜;
⑤可用稀硝酸与CaCO3作用制取CO2。
(2)将6.4g铜与一定浓度的浓硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为1.12L,请回答下列问题:
①写出铜与浓硝酸反应生成NO2气体的离子方程式:;
②参加反应的HNO3的物质的量是:mol。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D <E。其中A、B、C是同一周期的非金属元素,AC2为非极性分子。D单质与水形成的溶液具有漂白性。E的原子序数为24,ED3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)已知A、D形成的化合物分子空间构型为正四面体,而光气( )分子空间构型为平面三角形,说明原因。光气(
)分子空间构型为平面三角形,说明原因。光气(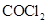 )分子中碳氧原子间的共价键的键型是(填序号)。
)分子中碳氧原子间的共价键的键型是(填序号)。
A.1个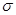 键B.2
键B.2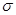 个键
个键
C.2个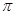 键D.1个
键D.1个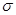 键,1个
键,1个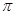 键
键
(3)写出等物质的量的D单质和SO2气体同时通入水中反应的离子方程式。
(4)ED3与B、C的氢化物形成的配合物的化学式为。
(12分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: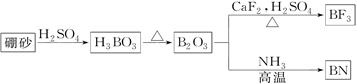
请回答下列问题:
(1)由B2O3制备BN的化学方程式是_____________________________________;
(2)B和N相比,电负性较大的是__________,BN中B元素的化合价为__________;
(3)在BF3分子中,F—B—F的键角是________, B原子的杂化轨道类型为________;
(4)BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________;
(5)六方氮化硼与石墨相似,层内B原子与N原子之间的化学键为_________,N原子L层的P电子比S电子多_________个。
(6)写出CaF2的电子式:________。
(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。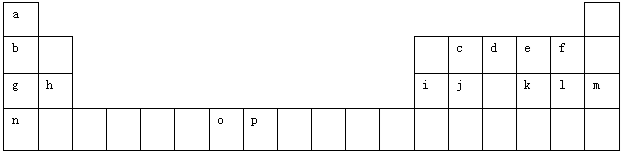
试回答下列问题:
(1)元素p的原子的电子占有种能量不同的原子轨道。
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为(用离子符号表示)。
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为______________,该分子是______(填“极性”或“非极性”)分子。
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____________。
(5)o、p两元素的部分电离能数据列于下表:
| 元素 |
o |
p |
|
| 电离能/kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____________________________________________________;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为,含有的化学键为。