已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。
请填写下列空白
(1)写出化学式:D ,K 。
(2)写出②的离子方程式 。
(3)反应④不属于下列何种反应类型 (填字母序号)。
A. 化合反应 B. 氧化还原反应 C. 离子反应 D. 置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为 (填序号)。
A. KSCN溶液和氯水 B. 铁粉和KSCN
C. 浓氨水 D. 酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式 。
(11分)物质结构和元素周期律是化学的重要理论知识,通过学习这部分知识,可以对所学元素化合物等知识从理论角度进一步加深理解。有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述完成下列问题:
(1)元素名称:A_________, B__________, C__________, D_________。
(2)写出B元素在周期表中的位置,第______周期,第________族。
(3)A与B可形成多种化合物,其中会引起温室效应的这一者的电子式为____________
(4)C单质在点燃条件下与B单质充分反应所得固体的化学为______________,该固体化合物类型为_______________,存在的作用力有________________。
(5) 用电子式表示化合物C2D的形成过程_____________________________________。
已知:(X代表卤素原子,R代表烃基)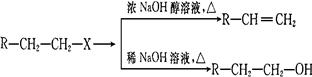
利用上述信息,按以下步骤从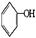 合成
合成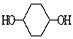 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是_________。(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为:___
(4)试写出C D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)
在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是,一定互为同分异构体的是。(填编号)
(11分)根据下面的反应路线及所给信息填空。
(1)A的结构简式是__________,名称是__________。
(2)①的反应类型是__________;②的反应类型是__________。
(3)反应④的化学方程式是________________________________________
有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应⑦溴乙烷和氢氧化钠乙醇溶液共热⑧溴乙烷和氢氧化钠水溶液共热⑨甲苯制三硝基甲苯
其中属于取代反应的是__________;属于氧化反应的是__________;属于加成反应的是__________;属消去反应的是__________;属于聚合反应的是__________