(11分)物质结构和元素周期律是化学的重要理论知识,通过学习这部分知识,可以对所学元素化合物等知识从理论角度进一步加深理解。有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述完成下列问题:
(1)元素名称:A_________, B__________, C__________, D_________。
(2)写出B元素在周期表中的位置,第______周期,第________族。
(3)A与B可形成多种化合物,其中会引起温室效应的这一者的电子式为____________
(4)C单质在点燃条件下与B单质充分反应所得固体的化学为______________,该固体化合物类型为_______________,存在的作用力有________________。
(5) 用电子式表示化合物C2D的形成过程_____________________________________。
X、Y、Z、W、V是原子序数依次增大的短周期主族元素,其中两种为金属元素。Y的原子半径是短周期主族元素中最大的,Z的单质可与Y的最高价氧化物的水化物溶液反应,X与W同主族,且W的原子序数是X的两倍。请回答下列问题:
(1)W的氢化物的电子式是,其相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,可能的原因是_________________________;
(2)Z的单质与Y的最高价氧化物的水化物溶液溶液反应的离子方程式是______________;
(3)X与W以原子个数比2∶1形成的化合物能使溴的水溶液褪色,写出反应的离子方程式__________,该化合物表现了性;
(4)V的单质溶于水后形成的溶液中存在的粒子有种。
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。全钒液流电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子【V2+(紫色)、V3+(绿色)、VO2+(蓝色)、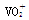 (黄色)】为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O
(黄色)】为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O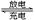 V2++
V2++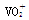 +2H+。如图1是钒电池基本工作原理示意图:
+2H+。如图1是钒电池基本工作原理示意图: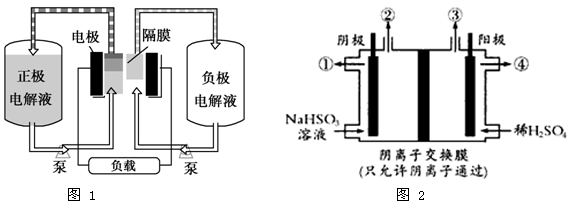
请回答下列问题:
(1)放电时的正极反应式为_________________________;
(2)充电时的阴极反应式为________________,充电过程中,电解液的pH(选填“升高”“降低”或“不变”)。
(3) 放电过程中氢离子的作用是____________________________;若充电时转移电子的数目为6.02×1023,则左槽溶液中H+的变化量为mol 。
(4) 以全钒液流电池为电源,用惰性电极电解NaHSO3溶液可制得硫酸,装置如图2所示。阴极的电极反应式为。
(5)电解过程中③处的生成物是(填化学式)。
工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3 。其过程如下图所示。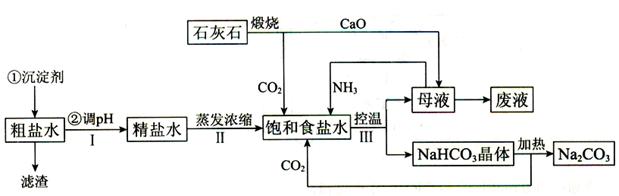
请回答:(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有___________________________________。
(2)将CaO投入含有大量的NH4C1的母液中,能生成可循环使用的NH3,该反应的化学方程式是__________________________________。
(3)向饱和食盐水中首先通入的气体是_______________________,过程III中生成NaHCO3晶体的反应的化学方程式是_________________________________________________________。
(4)碳酸钠晶体失水的能量变化示意图如下: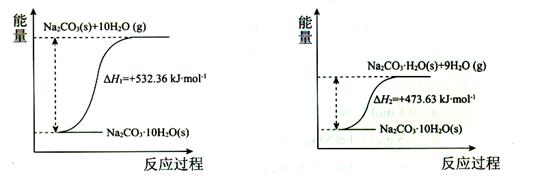
Na2CO3·H2O(s)脱水反应的热化学方程式是。
(5)产品纯碱中常含有NaCl。取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体。则该产品中Na2CO3的质量分数是。
(6)熔融Na2CO3可作甲烷-空气燃料电池的电解质,该电池负极的反应式是_________________。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: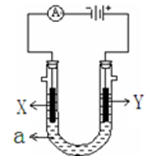
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的实验现象是。
②电解NaCl溶液的离子方程式是。
③将Y电极反应产物通入Na2S溶液中,发生反应的离子方程式为。
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为,工作一段时间后pH将___________(填“增大”或 “减小”或“不变”) 。
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2g,该金属的摩尔质量是______________。
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3  Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3  2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是。
(2)“③”中调节pH至4.7,目的是。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+  Cr(OH)3。绿矾还原CrO42-的离子方程式为:。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol/L的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是Kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为:。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol/L的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是Kg(保留两位小数)。