在第3周期中,原子半径最大的金属元素是 ,(填元素符号,下同)离子半径最小的离子是 ,化学性质最稳定的元素是 ,最高价氧化物对应水化物的酸性最强的化合物的化学式是 ,最高价氧化物对应水化物的碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为 、 。
下列各组物质的分离或提纯,,应选用下述方法的哪一种(填序号)
A分液 B过滤 C萃取D蒸馏 E重结晶F加热分解
(1)从碘水中提取碘____________
(2)用自来水制取蒸馏水____________
(3)分离植物油和水____________
(4)除去溶液中的悬浮的CaCO3____________
(5)除去NaCl中所含少量KNO3___________
(6)除去KCl中少量的 KClO3____________
1个H2SO4分子中含有_______ 个氢原子,_______个氧原子,6.02×1023个H2SO4分子中H原子的物质的量_______,氧原子的物质的量_______。
影响气体体积的因素是__ ____、__ ___。
物质的量是表示___________________的物理量,符号______,单位_______。
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下: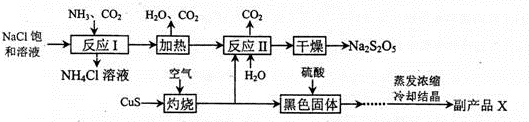
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作________________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L(标准状况下),则转移电子____ mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为_______________。
(4)副产品X的化学式是 ________________,在上述流程中可循环使用的物质是___________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂________________。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠
④酸性高锰酸钾 ⑤稀硫酸