利用下图电解装置进行实验。
(1)若a、b是惰性电极,电解质溶液是氯化钠溶液,a极是 极,总反应的离子方程式是 。
(2)若a、b是惰性电极,电解质溶液是硝酸银溶液,b极上的现象是 ,总反应的离子方程式是 。
(3)若a、b是惰性电极,电解质溶液是硫酸钾溶液,a极上的电极反应是 ,若两极附近分别加入石蕊试液,两极附近的现象是 。
已知有一白色粉末是由NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成是 __;
(2)若推测该粉末只由Na2SO4组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。[可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸]
| 实验步骤 |
实验现象 |
反应离子方程式和结论 |
| ④ |
注:实验步骤的序号由你按顺序编号。实验现象、离子方程式和结论要与相应的实验步骤一一对应。
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl.3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是_________________________ ______;
(2)反应前向A中放入碎瓷片的目的是_______________________________,装置A、B、E、三处均需要加热,A、B、E三处加热的先后顺序是(用A、B、E表示) ;
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。向滤液中加入KSCN溶液,溶液不显红色,说明滤液中不含有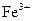 离子,你认为滤液中不含有
离子,你认为滤液中不含有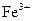 离子可能的原因是:__________________________________________。
离子可能的原因是:__________________________________________。
(4)该小组利用(3)中滤液制取FeCl3•6H2O晶体设计流程如下:
①步骤I若向100mL滤液中通入224mL Cl2(标准状况下)恰好完全反应,则原滤液中金属离子浓度约为__________mol/L。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_______________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合必要的离子方程式简要说明)
__________________________________________________________________。
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2ONH4Cl+NaHCO3(晶体)依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水是因为。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体。现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,利用本题所提供的试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该晶体是碳酸氢钠晶体,而不是碳酸氢铵或食盐晶体,简述操作方法、实验现象及结论:
。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为。
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题: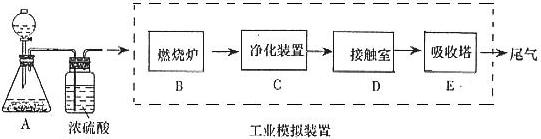
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为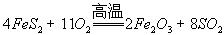 ,在该反应中____________做氧化剂,若消耗了
,在该反应中____________做氧化剂,若消耗了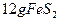 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_____________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成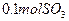 ,可放出
,可放出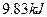 的热量,请写出该反应的热化学方程式__________________________________________;
的热量,请写出该反应的热化学方程式__________________________________________;
并回答在工业中不采取加压措施的原因
__________________________________________________________________;
(5)为检验从接触室出来的气体成分,甲同学设计如下实验: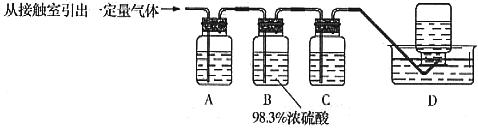
①A中盛放的试剂是____________________;
②B中盛放98.3%浓硫酸的作用是__________________________________________,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案________(填“可行”或“不可行”)说明理由_________________________________________________
_______________________________;
③C中盛放的试剂是___________________________,其作用是__________________。
一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
I.甲同学的方案如图所示: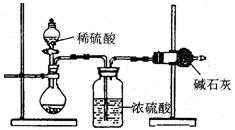
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分
数的数据存在较大的偏差,你认为原因可能是(填序号)。
| A.装置内原有空气中的二氧化碳气体也被碱石灰吸收 |
| B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收 |
| C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收 |
| D.加入稀硫酸的量不足,则可能造成误差 |
II.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,
称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)洗涤沉淀的操作要点是。
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是。