下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
下列各分子中,所有原子都满足最外层为8电子结构的是()
| A.H2O | B.BF3 | C.PCl5 | D.CCl4 |
某二价阳离子含24个电子,它的质量数为59,则该离子核内中子数是()
| A.22 | B.37 | C.33 | D.35 |
元素性质呈现周期性变化的根本原因是()
| A.元素的相对原子质量递增,量变引起质变 |
| B.元素的原子半径呈周期性变化 |
| C.元素原子的核外电子排布呈周期性变化 |
| D.元素的化合价呈周期性变化 |
下图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的园球代表不同原子。下列说法错误的是( )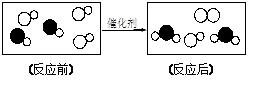
| A.图中生成物全部是化合物 |
| B.原子在化学变化中是不可分的 |
| C.此反应有单质生成 |
| D.参加反应的两种分子的个数比为1∶1 |
下列可证明甲烷分子是正四面体结构的是( )
| A.一氯甲烷没有同分异构体 | B.二氯甲烷没有同分异构体 |
| C.三氯甲烷没有同分异构体 | D.四氯甲烷没有同分异构体 |