下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(nm) |
0.186 |
0.160 |
0.152 |
0.143 |
0.110 |
0.099 |
0.075 |
0.074 |
| 主要化合价 |
+1 |
+2 |
+1 |
+3 |
+5、 -3 |
+7、 -1 |
+5、 -3 |
-2 |
回答下列问题:⑧在元素周期表中的位置是(周期、族) 。
在这8种元素的最高价氧化物的水化物中,酸性最强的是 (填化学式)。
①元素和⑥元素形成化合物的电子式是 。
写出①和④的最高价氧化物对应水化物反应的离子方程式:
。②、④、⑤、⑥的简单离子的离子半径由大到小的顺序是: > > > 。(填离子符号)
比较⑤、⑦气态氢化物的稳定性 > (用分子式表示)
下列叙述中不正确的是 (填字母)。
| A.③、④处于不同周期 |
| B.⑥在同主族元素中非金属性最强 |
| C.⑤元素与⑦元素两者核电荷数之差是8 |
| D.①与⑧形成的化合物只含有离子键 |
某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其最大质荷比为118;其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;其苯环上只有一个取代基。以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题: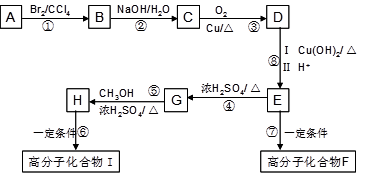
(1)A的结构简式为(2)E中的官能团名称是
(3)G的结构简式为(4)反应②、④的反应类型分别是
(5)反应⑥、⑦生成的高分子化合物的反应原理是否相同?
(6)写出下列反应的化学方程式:
反应③;反应⑦
(7)符合以下条件的C的同分异构体有种(不考虑立体异构)
a、苯环上有两个取代基
b、苯环上的一氯代物有两种
c、加入三氯化铁溶液显色
d、向1mol该物质中加入足量的金属钠可产生1mol氢气
A、B、C、D、E五种溶液分别是HCl、CH3COOH、NaOH、NH3.H2O、Na2CO3溶液中的一种。常温下进行下列实验:
①将1L PH=9的A溶液分别与xL 0.001mol/L B溶液、yL 0.001mol/L D溶液充分反应后溶液呈中性,x、y大小关系为:y<x;
②浓度均为0.1 mol/L C与D溶液等体积混合,溶液呈酸性;
③浓度均为0.1 mol/L A和E溶液的PH:A< E
回答下列问题:
(1)E的电子式
(2)写出A与足量B溶液反应的离子方程式
(3)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,产生H2的物质的量之比为
(4)将等体积、等物质的量浓度的B和C混合后,所得溶液的PH约为7,原因是
(5)室温时在一定体积0.4 mol/L的E溶液中,加入一定体积的0.1 mol/L的D溶液时,混合溶液PH=13,若混合后溶液的体积变化忽略不计,则D、E溶液的体积之比是
某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染。流程如下:
回答下列问题:
(1)写出以石墨为电极电解饱和食盐水的离子方程式
(2)写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式,生成1mol四氯化钛时转移电子的物质的量为mol
(3)利用四氯化钛制备TiO2.xH2O时,需加入大量的水并加热的目的是
(4)钛广泛用于航天领域。氩气在冶炼钛的流程中的作用是
(5)利用CO和H2制备甲醇
①已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol。写出CO和H2制备甲醇的热化学方程式
②假设联合生产中各原料利用率为100%,若得到6mol甲醇,则只需再补充标准状况下的H2L
“百度百科:乙醇,俗称酒精,在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有酒香的气味,并略带刺激性,微甘。易燃,能与水以任意比互溶。用途很广,可用制造饮料、染料、燃料等。在国防工业、医疗卫生、有机合成、食品工业、工农业生产中都有广泛的用途。”根据所学知识回答下列问题
(1)书写乙醇催化氧化的产物和新制银氨溶液反应的化学方程式:
(2)在120℃,101kpa条件下,取ag乙醇在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量增加了bg,则ab(填“=”“>”“<”)
(3)乙醇燃料电池,KOH作电解质,书写负极电极反应式:
(4)请用所学知识解释为什么乙醇能和水以任意比互溶
亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。
(1)亚磷酸是_______元酸。
(2)PCl3水解可制取亚磷酸:PCl3+3H2O=_________
(3)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-
H++H2PO3-
①某温度下,0.10mol∙L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×10-2mol∙L-1。求该温度下上述电离平衡的平衡常数K=_______。(只考虑H3PO3的第一步电离,结果保留两位有效数字。)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH_____7(填“>”“=”“<”)
(4)亚磷酸具有还原性,可使碘水褪色。该反应的化学方程式为_______________。
(5)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下: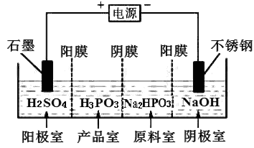
①阴极的电极反应式为__________。②产品室中反应的离子方程式为__________________。