矿物燃料在使用的过程中会产生大量污染性物质,如SO2和CO2,而H2和NH3都被认为是理想的清洁能源。
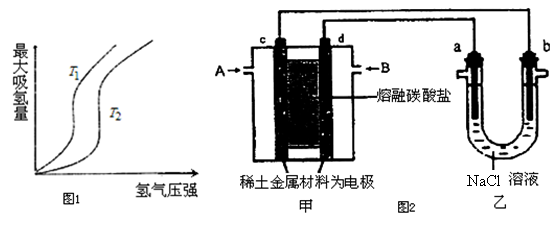
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0(M表示某种合金)如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系.则下列说法中,正确的是___________;
a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.上述反应可实现多次储存和释放氢气
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体.图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
①工作过程中,甲装置中d电极上的电极反应式是________________;乙装置中电极a为_______极(填电极名称)。
②若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH=__________。(忽略电解前后溶液的体积变化)
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质.
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1 2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1试写出氨气在氧气中燃烧生成液态水的热化学方程式________________;
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)+3H2(g)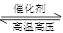 2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%。
2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%。
①该反应的平衡常数表达式为:K=______________;
②能判断该反应是否达到化学平衡状态的依据是____________
a、容器中压强不变 b、混合气体的密度不变 c、3v正(H2)=2v逆(NH3) d、c(N2): c(H2): c(NH3)=1:3:2
③对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的___________
a、选用更高效的催化剂 b、升高温度 c、及时分离出氨气
d、增加H2的浓度 e、充入He,使体系总压强增大
工业上以Al(OH)3、H2SO4、(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图所示:
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为 。
(2)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为 。
NH3·H2O+H+,则该反应的平衡常数为 。
(3)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为 。
(4)固体NH4Al(SO4)2·12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体的成分为 。
(5)综上分析,流程图中M混合气体的主要成分的化学式为 。M可用一种物质吸收以实现循环利用,该物质的名称是 。
下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答: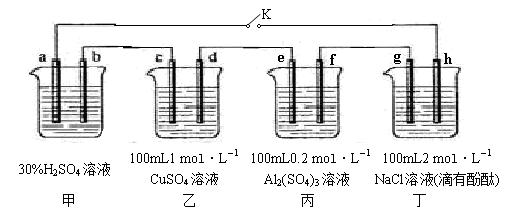
(1)a电极的电极材料是 (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为 。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量是 。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为 极,d电极上发生反应的电极反应式为 。
(5)电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。已知CH3COOH的电离平衡常数为1.75×10-5,则a/b = 。
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO+2CO 2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
① T1_(填“>”“<”或“=”)T2。
② 在T2温度下,0~2s内的平均反应速率v(N2)=________。
(2)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。通入O2的一极为_______(填“正极”或“负极”),该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为_________。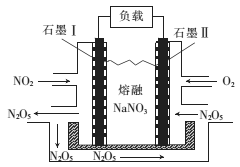
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
铍作为一种新兴材料日益被重视,铍是原子能、火箭、导弹,航空、宇宙航行以及冶金工业中不可缺少的宝贵材料。
(1)13Be2+的中子数为_____,其结构示意图为_______。
(2)铍在氧气中燃烧,得到白色粉未状的氧化铍BeO,BeO的熔点为2803K,难溶于水,其熔融物难电离,化合物BeO的化学键类型为______(填“共价键”或“离子键”)。
(3)铍既能溶于酸也能溶于碱,与碱反应生成BeO22-。写出铍与NaOH溶液反应的离子方程式:_______________。