常温下,用 0.1000 mol·L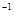 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L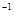
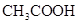 溶液所得滴定曲线如下图。下列说法正确的是
溶液所得滴定曲线如下图。下列说法正确的是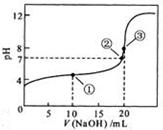
A.点①所示溶液中: |
B.点②所示溶液中: |
C.点③所示溶液中: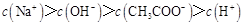 |
D.滴定过程中可能出现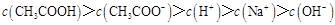 |
将25 ℃的纯水加热至80 ℃,下列叙述正确的是
| A.水的离子积不变 |
| B.水的pH变小,呈酸性 |
| C.水的pH变大,呈中性 |
| D.水中C(H+)=C(OH-)>1×10-7 mol/L |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中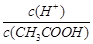 值增大,可以采取的措施是
值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.降低温度 |
| C.加少量冰醋酸 | D.加水 |
已知HCN、CN—在溶液中存在下列平衡及其对应的平衡常数:
①HCN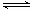 H++CN—△H1>0 K1
H++CN—△H1>0 K1
②CN—+H2O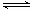 HCN+OH-△H 2>0 K2
HCN+OH-△H 2>0 K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是
| A.混合溶液的pH<7 |
| B.对混合溶液进行微热,K1增大、K2减小 |
| C.K2≈ 1.6×10-5 |
| D.c(Na+) =" c(HCN)" + c(CN‑) |
将浓度为0.1 mol/L的HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.Ka(HF) | C.c(F-) | D.c(OH-) |
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 |
HF |
HClO |
H2CO3 |
| 电离平衡常数 |
6.8×10-4 |
4.7×10-8 |
K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是
A.常温下,同物质的量浓度NaClO与NaHCO3溶液,前者的pH较小
B.若某溶液中c(F—)=c(ClO—),往该溶液中滴入HCl,F-比ClO-更易结合H+
C.往饱和Na2CO3溶液中逐滴加入稀盐酸至过量,所得溶液中c(HCO3—)先增大后减小
D.同温下,等体积、等pH的HF和HClO分别与NaOH完全反应,消耗等量的NaOH