把足量熟石灰放入蒸馏水中,一段时间后达到平衡:
Ca(OH)2(s)  Ca2+(aq)+2OH-(aq),下列叙述正确的是
Ca2+(aq)+2OH-(aq),下列叙述正确的是
| A.给溶液加热,溶液的pH升高 |
| B.恒温下向溶液中加入CaO,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多 |
| D.向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多 |
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)  2NH3(g)ΔH=-92.4kJ·mol
2NH3(g)ΔH=-92.4kJ·mol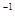 ),下列说法错误的是
),下列说法错误的是
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的平衡浓度(mol·L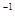 ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
a1 |
a2 |
a3 |
A.2c1<c3 B.a+b=92.4 C.a1+a3<1 D.p3>2p2=2p1
X、Y、Z三种气体,取X和Y按2∶1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X + 2Y 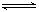 2Z,达到平衡后,X的转化率不可能为
2Z,达到平衡后,X的转化率不可能为
| A.10% | B.15% | C.20% | D.25% |
在298K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol/L NaOH溶液中充分反应,
测得反应放出x kJ的热量.已知在该条件下,1 mol CO2通入1 L 2 mol/L NaOH溶液中
充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
| A.CO2 (g)+NaOH(aq)="==" NaHCO3 (aq)ΔH=-(2y-x) kJ/mol |
| B.CO2 (g)+NaOH(aq)="==" NaHCO3 (aq) ΔH=-(2x-y) kJ/mol |
| C.CO2 (g)+NaOH(aq)="==" NaHCO3 (aq)ΔH=-(4x-y) kJ/mol |
| D.CO2(g)+2NaOH(l)="==2" NaHCO3 (l)ΔH=-(8x-2y) kJ/mol |
一定温度下,下列溶液的离子浓度关系式正确的是
| A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合: c(Na+)+c(H+)=c(OH-)+c(HC2O  ) ) |
| D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
①K+、Cl―、NO3―、S2―②K+、Fe2+、I―、SO42―③Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
| A.③⑤ | B.①③⑤ | C.③④ | D.②⑤ |