6分)
(I)常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0. 5L混合溶液。
(1)溶液中共有________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是____________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________mol。
(II)在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
(1)若加入AgNO3固体,c(I-) 。
(2)若加入更多的AgI固体,则c(Ag+)
(3)若加入固体AgBr,c(I-) 。
下列液体均处于25℃,有关叙述不正确的是( )
| A.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
入大量SO3 D.降低体系温度
下列实验中,由于错误操作导致所测出的数据一定偏低的是()
| A.用量筒测量一定液体的体积时,仰视读出的读数 |
| B.用标准盐酸滴定氢氧化钠溶液测碱液浓度时,酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液,所测出的碱液的浓度值 |
| C.测定硫酸铜晶体结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量 |
| D.做中和热测定时,在大小烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值 |
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是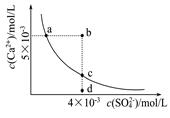
| A.a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
| C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
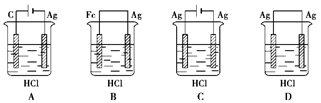
某学生欲完成反应2HCl+2Ag="=" 2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是