有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯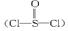 中形成的,电池总反应方程式为:8Li+3SOCl2====6LiCl+Li2SO3+2S,下列叙述中正确的是( )
中形成的,电池总反应方程式为:8Li+3SOCl2====6LiCl+Li2SO3+2S,下列叙述中正确的是( )
| A.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1 |
| B.电解质溶液中混入碱溶液,对电池反应无影响 |
| C.电池的正极为:Li-e-====Li+ |
| D.电池工作过程中,亚硫酰氯(SOCl2)仅被还原为Li2SO3 |
下列说法正确的是
| A.蛋白质、纤维素、蔗糖、聚乙烯、淀粉都是高分子化合物 |
| B.石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
| C.完全燃烧只生成CO2和H2O的化合物一定是烃 |
| D.乙烯、乙醇、SO2、FeSO4都能使酸性高锰酸钾溶液褪色 |
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程中产生二氧化碳的体积与时间的关系如图所示,下列叙述正确的是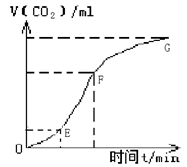
| A.OE段化学反应速率最快 |
| B.EF段化学反应速率最快 |
| C.FG段收集的二氧化碳气体最多 |
| D.由图可推断出该反应是吸热反应 |
上个世纪80年代,科学家通过研制发现了一种新型分子,这种新型分子具有空心的类似足球状的结构,其化学式是C60。有关C60的下列说法中正确的是
| A.C60中可能含有离子键 | B.C60中的化学键只有共价键 |
| C.C60是一种新型的化合物 | D.C60和金刚石互为同位素 |
化学反应N2 + 3H2 ="==" 2NH3的能量变化如图所示,以下叙述正确的是
| A.1/2 mol N2和3/2 mol H2转变为原子是放出能量a KJ |
| B.1mol N 和3mol H结合成1mol NH3(g)时放出热量b KJ |
| C.1mol NH3(l)转变为1mol NH3(g)时放出热量 c KJ |
| D.1/2 mol N2和3/2 mol H2反应生成1mol NH3(l)是吸热反应 |
关于锂的结构和性质判断错误的是
①与水反应比钠剧烈②原子半径小于钠③有Li2O、Li2O2两种氧化物
④它的阳离子最外层电子数与钠的阳离子相同⑤它是还原剂
| A.③⑤ | B.①②③ | C.①③④ | D.①③ |