在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器中,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
 时间 (s)浓度 mol·L-1 |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) |
0.20 |
C1 |
0.10 |
C3 |
C4 |
C5 |
| C(NO2) |
0.00 |
0.12 |
C2 |
0.22 |
0.22 |
0.22 |
根据表格提供数据,请回答下列各小题:
⑴该反应的化学方程式为:
表示C2 C3 C4 (填 < , > 或 = )
⑵ 20S时,四氧化二氮的浓度C1=
在0~20 S内四氧化二氮的平均反应速度为
(1) M(SO2)是, 0.25 mol O2的标准状况下的体积约为;
(2)9 gH2O的物质的量是, 28 g CO所含的电子数为;
(3)病人输液用的葡萄糖注射液是葡萄糖(化学式为:C6H12O6)的水溶液,其标签上的部分内容如右图所表示.利用标签所提供的信息,回答下列问题: 
①该注射液中葡萄糖的质量分数为,
②该注射液中葡萄糖的物质的量浓度为。
在一定条件下,可逆反应A2(g)+B2(g)  2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol•L-1, c(B2)=0.1mol•L-1,c(C)=1.6mol•L-1。若A2、B2、C的起始浓度分别为a mol•L-1、b mol•L-1、g mol•L-1请确定:
2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol•L-1, c(B2)=0.1mol•L-1,c(C)=1.6mol•L-1。若A2、B2、C的起始浓度分别为a mol•L-1、b mol•L-1、g mol•L-1请确定:
(1)a、g应满足的关系式为_________。
(2)若反应从正反应方向开始进行,当g=_________,a有最大值为_________。
(3)若反应从逆反应方向开始进行,当b=_________,a有最小值为_________。
(4)b的取值范围为________________。
在密闭容器中,将2.0 mol CO与10mol H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g) 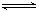 CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol•L-1,c(H2O)=6.0mol•L-1,c(CO2)=3.0mol•L-1,c(H2)= 4.5mol•L-1,则此时该反应向_________方向移动。
CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol•L-1,c(H2O)=6.0mol•L-1,c(CO2)=3.0mol•L-1,c(H2)= 4.5mol•L-1,则此时该反应向_________方向移动。
在标准状况下,将224L HCl气体溶于635mL水(ρ=1.00g·cm-3)中,所得盐酸的密度为1.18g·cm-3。此溶液物质的量浓度应该为多少?若取出这种盐酸10.0mL,向其中加水配制成1L溶液,则所得稀盐酸的物质的量浓度应该为多少?
(共9分,每小题3分)常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
①该溶液中阴阳离子的总物质的量②该溶液中CuSO4的物质的量浓度
③取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?(计算过程规范)